О КОМПАНИИ (ABOUT THE COMPANY)
"S.A.I.D - лабораторные решения"
производит и реализует стерильные биологические и химические растворы высокой степени очистки действующего вещества 99,9%
и стерильные компоненты для их производства, предназначеные для работы в медицинских лабораториях и биолабораториях,
а также для научных исследований. Продукция компании представлена на рынках США, Азии, Европы, России.
Все растворы имеют соответствующие сертификаты.
Наши продукты нельзя купить в аптеке, а только на нашем сайте или у наших представителей
"S.A.I.D - laboratory solutions"
produces and sells sterile biological and chemical solutions of a high degree of purification of the active substance 99.9%
and sterile components for their production, intended for use in medical laboratories and biological laboratories,
and also for scientific research. The company's products are represented in the markets of the USA, Asia, Europe, and Russia.
All solutions have the appropriate certificates.
Our products cannot be bought at a pharmacy, but only on our website or from our representatives

Представленные стерильные биологические растворы компании "S.A.I.D - laboratory solutions" — это продукция, аналогов соответствующего качества которой не существует на мировом рынке.
Растворы готовятся из высокоочищенных (более 99,5%) биологического происхождения веществ с определенным химическим составом, который подтвержден документально сертификатом анализа.

Все продукты, которые мы предлагаем, производятся компанией "S.A.I.D - laboratory solutions" в специализированных лабораториях. Наши лаборатории имеют международный сертификат GMP, а значит они соответствуют самым высоким мировым стандартам и требованиям.
Мы сами контролируем весь процесс производства, распространения и продажи, поэтому можем поставлять продукцию наивысшего качества.
Узнать больше

Для того, чтобы обеспечить быструю доставку и отсутствие таможенных сборов, наша продукция поставляется из складов в России и Кипра.
На странице оформления заказа вы увидите местоположение, с которого будет осуществляться отправка вашего заказа.
Узнать больше
Представленные стерильные биологические растворы компании "S.A.I.D - laboratory solutions" — это продукция, аналогов соответствующего качества которой не существует на мировом рынке.
Растворы готовятся из высокоочищенных (более 99,5%) биологического происхождения веществ с определенным химическим составом, который подтвержден документально сертификатом анализа.
Все продукты, которые мы предлагаем, производятся компанией "S.A.I.D - laboratory solutions" в специализированных лабораториях. Наши лаборатории имеют международный сертификат GMP, а значит они соответствуют самым высоким мировым стандартам и требованиям.
Мы сами контролируем весь процесс производства, распространения и продажи, поэтому можем поставлять продукцию наивысшего качества.
Узнать больше
Для того, чтобы обеспечить быструю доставку и отсутствие таможенных сборов, наша продукция поставляется из складов в России и Кипра.
На странице оформления заказа вы увидите местоположение, с которого будет осуществляться отправка вашего заказа.
Узнать больше

НАШИ ПРЕИМУЩЕСТВА

Мы создаем продукцию, аналогов которой не существует.
Это мы можем сказать в отношении каждого представленного продукта
Уникальность продукции

Чистота основного вещества выше 99%
Подтверждено соответствующими документами

Продукция произведена в соответствии с GMP стандартами, в лаборатории, имеющий сертификат GMP

Наша продукция стерильна
Подтверждено соответствующими документами

Продукция не содержит запрещенных законодательством веществ (наркотических, психотропных, а также сильнодействующих веществ)
Подтверждено соответствующими документами
Уникальность сервиса

Доставка по всему миру с наших складов в России и на Кипре

Возможноть возврата в течении 30 дней с момента покупки (при условии если упаковка не повреждена и не испорчен товарный вид)

Индивидуальные скидки при покупке от 10 единиц продукции

Наличие сертификатов и прочих документов, на представленую продукцию

КАК ОФОРМИТЬ ЗАКАЗ (HOW TO PLACE AN ORDER)

Оформление заказа не занимает много времени. После оформления заказа с вами свяжется наш менеджер
и предложит варианты оплаты. Оформить заказ во все страны мира возможно прямо тут на сайте.
С условиями доставки, оплаты, возврата вы можете ознакомится на страницах данного сайта.
Для удобства вы всегда сможете написать в службу поддержки
Placing an order does not take much time. After placing an order, our manager will contact you
and offer payment options. You can place an order to all countries of the world right here on the site.
You can familiarize yourself with the terms of delivery, payment, return on the pages of this site.
For convenience, you can always write to the support service

ВЫБЕРИТЕ ТОВАРЫ →
Выберите интересующие Вас товары, воспользовавшись нашим удобным каталогом товаров на сайте.

ПОЛУЧИТЕ КОНСУЛЬТАЦИЮ →
После того, как Вы оформите заказ, наш менеджер свяжется с Вами для уточнения деталей по заказу, оплате и доставке.

ЗАБЕРИТЕ СВОЙ ТОВАР →
Мы подготовим выбранные вами товары к самовывозу или организуем их доставку к Вам домой или в офис Вашей компании.
ВЫБЕРИТЕ ТОВАРЫ →
Выберите интересующие Вас товары, воспользовавшись нашим удобным каталогом товаров на сайте.
ПОЛУЧИТЕ КОНСУЛЬТАЦИЮ →
После того, как Вы оформите заказ, наш менеджер свяжется с Вами для уточнения деталей по заказу, оплате и доставке.
ЗАБЕРИТЕ СВОЙ ТОВАР →
Мы подготовим выбранные вами товары к самовывозу или организуем их доставку к Вам домой или в офис Вашей компании.

ПРИНИМАЕМ К ОПЛАТЕ

Вы можете воспользоваться всеми удобными для Вас способами оплаты, представленными на нашем сайте.
По вопросам партнерской работы вы можете позвонить нам по телефону или написать в поддержку

НАЛИЧНЫЕ ДЕНЬГИ

БАНКОВСКИЕ КАРТЫ

СБЕР ОНЛАЙН

БЕЗНАЛИЧНЫЙ РАСЧЕТ
НАЛИЧНЫЕ ДЕНЬГИ
БАНКОВСКИЕ КАРТЫ
СБЕР ОНЛАЙН
БЕЗНАЛИЧНЫЙ РАСЧЕТ

ОТЗЫВЫ НАШИХ КЛИЕНТОВ

Компания производит и реализует стерильные биологические и химические растворы для работы
в медицинских лабораториях и биолабораториях, а также для научных исследований.

Дмитрий Ростовцев
21 января 2022, 21:39
★★★★★
Амигдалин В17 в растворе производства S.A.I.D является эталоном стерильной продукции. Наша лабораторя занимается исследованиями метаболических процессов в живых клетках и данный раствор более чем подходит для подобной работы.

Светлана Шехтман
10 августа 20222, 19:07
★★★★★
Для меня важно, что доставка раствора осуществляется достаточно быстро. Я живу в Израиле и сюда доставка составила менее двух недель.

Александр Барков
21 ноября 2021, 21:39
★★★★★
Отзывы пишу редко. И не умею их писать. Амигдалин В17 покупаю по рекомендации. До этого перерыл весь интернет и, к сожалению, аналогов на нашем континенте не нашел. Радует наличие сертификатов, это, действительно, повышает доверие к продукции.
Дмитрий Ростовцев
21 января 2022, 21:39
★★★★★
Амигдалин В17 в растворе производства S.A.I.D является эталоном стерильной продукции. Наша лабораторя занимается исследованиями метаболических процессов в живых клетках и данный раствор более чем подходит для подобной работы.
Светлана Шехтман
10 августа 20222, 19:07
★★★★★
Для меня важно, что доставка раствора осуществляется достаточно быстро. Я живу в Израиле и сюда доставка составила менее двух недель.
Александр Барков
21 ноября 2021, 21:39
★★★★★
Отзывы пишу редко. И не умею их писать. Амигдалин В17 покупаю по рекомендации. До этого перерыл весь интернет и, к сожалению, аналогов на нашем континенте не нашел. Радует наличие сертификатов, это, действительно, повышает доверие к продукции.
Получите консультацию (Get a consultation)
Оставьте заявку прямо сейчас, специалист нашей компании свяжется с Вами в самое ближайшее время!
Leave a request right now, our company's specialist will contact you as soon as possible!
Узнавайте первыми обо всех новостях!
Совместное введение амигдалина и дезоксиниваленола нарушило регуляторные белки, связанные с пролиферацией клеток свиных яичников in vitro
Совместное введение амигдалина и дезоксиниваленола нарушило регуляторные белки, связанные с пролиферацией клеток свиных яичников in vitro
Оригинал статьи: https://www.researchgate.net/publication/318430770_Co-administration_of_amygdalin_and_deoxynivalenol_disrupted_regulatory_proteins_linked_to_proliferation_of_porcine_ovarian_cells_in_vitro
Дезоксиниваленол (ДОН) представляет собой один из наиболее распространенных трихотеценовых микотоксинов, вырабатываемых видами Fusarium, вызывая экономические и медицинские последствия. С другой стороны, было показано, что амигдалин обладает как профилактическими, так и лечебными свойствами, поэтому он использовался в качестве традиционного лекарства из-за его широкого спектра медицинских преимуществ, включая лечение или профилактику рака, снятие лихорадки, подавление кашля и утоление жажды. Целью этого исследования in vitro была оценка потенциального воздействия натурального продукта амигдалина в сочетании с микотоксином дезоксиниваленолом (ДОН) на ключевые регуляторы пролиферации клеток и апоптоза в гранулезных клетках яичников свиней. Клетки гранулезы яичников инкубировали в течение 24 ч с амигдалином (1, 10, 100, 1000, 10 000 мкг.мл⁻¹) в сочетании с дезоксиниваленолом (1 мкг.мл⁻¹), в то время как контрольная группа оставалась необработанной. Наличие пролиферативных (циклин B1, PCNA) и апоптотических маркеров (каспаза-3) в клетках гранулезы яичников свиней после обработки амигдалином (1, 10, 100, 1000, 10 000 мкг.мл⁻¹) в сочетании с дезоксиниваленолом (1 мкг.мл⁻¹) было обнаружено с помощью иммуноцитохимии. Присутствие пролиферативных (циклин B1, PCNA) и апоптотических маркеров (каспаза-3) в гранулезных клетках яичников свиней было обнаружено с помощью иммуноцитохимии. Совместное введение амигдалина и ДОН значительно (p < 0,05) увеличило количество гранулезных клеток, содержащих циклин B1 и PCNA во всех протестированных концентрациях по сравнению с контролем. Однако процент гранулезных клеток, содержащих основной апоптотический маркер каспазу-3, не отличался после совместного введения амигдалина и ДОН. Подводя итог, результаты этого исследования in vitro указывают на то, что совместное воздействие амигдалина и дезоксиниваленола может стимулировать пептиды, связанные с пролиферацией, в гранулезных клетках яичников свиней и, таким образом, изменять пролиферацию клеток и нормальное развитие фолликулов.
Амигдалин блокирует рост клеток рака мочевого пузыря in vitro, уменьшая циклин А и cdk2
Амигдалин блокирует рост клеток рака мочевого пузыря in vitro, уменьшая циклин А и cdk2
Оригинал статьи:
https://neue-krebstherapie.com/wp-content/uploads/2015/03/Amygdalin_PlosOne_Wachstum_Blase.pdf
Аннотация
Амигдалин, природное соединение, использовалось многими онкологическими больными в качестве альтернативного подхода к лечению их болезни. Однако, действительно ли это вещество оказывает противоопухолевое действие, так и не было установлено. Было начато исследование in vitro для изучения влияния амигдалина (1,25-10 мг/мл) на рост панели линий клеток рака мочевого пузыря (UMUC-3, RT112 и TCCSUP). Были исследованы рост опухоли, пролиферация, клональный рост и прогрессирование клеточного цикла. Были исследованы белки, регулирующие клеточный цикл cdk1, cdk2, cdk4, циклин A, циклин B, циклин D1, p19, p27, а также сигналы, связанные с мишенью рапамицина млекопитающих (mTOR), phosphoAkt, phosphoRaptor и phosphoRictor. Амигдалин дозозависимо снижал рост и пролиферацию во всех трех линиях клеток рака мочевого пузыря, что отражалось в значительной задержке прогрессирования клеточного цикла и остановке G0/G1. Молекулярная оценка выявила снижение phosphoAkt, phosphoRictor и потерю компонентов Cdk и циклина. Поскольку наиболее выдающиеся эффекты амигдалина наблюдались на оси cdk2-циклин A, были проведены исследования по снижению siRNA, выявившие положительную корреляцию между уровнем экспрессии cdk2/циклин A и ростом опухоли. Таким образом, амигдалин может блокировать рост опухоли путем снижения модуляции cdk2 и циклина A. Для оценки практической ценности амигдалина как противоопухолевого препарата необходимо провести исследование in vivo.
Долгосрочная стабилизация метастатической меланомы с помощью дихлорацетата натрия
Долгосрочная стабилизация метастатической меланомы с помощью дихлорацетата натрия
Акбар Хан, Дуг Эндрюс, Джилл Шейнхаус, Аннеке С. Блэкберн
Акбар Хан, Дуглас Эндрюс, Medicor Cancer Centres Inc., Торонто, Онтарио M2N 6N4, Канада
Джилл Шейнхаус, Insight Naturopathic Clinic, Торонто, ON M4P 1N9, Канада
Аннеке С. Блэкберн, Школа медицинских исследований Джона Кертина, Австралийский национальный университет, Канберра, ACT 2601, Австралия
Вклад авторов: Хан А. лечил пациента и написал большую часть отчета о случае; Эндрюс Д. помогал в разработке протокола натурального лечения для снижения побочных эффектов DCA и написал часть отчета о случае; Шейнхаус Дж. лечил пациента с помощью натуральной терапии; Блэкберн А.С. интерпретировал отчет о случае в контексте литературы по исследованиям DCA in vitro и in vivo, написал части введения и обсуждения, а также просмотрел рукопись в целом.
Заявление об информированном согласии: Пациентка, описанная в данной рукописи, дала согласие на публикацию своего случая анонимно.
Заявление о конфликте интересов: Один из авторов (Хан) проводит терапию дихлорацетатом для онкологических больных через онкологические центры Medicor Cancer Centres за плату и без получения прибыли. Клиника принадлежит члену семьи этого автора. Другим авторам нечего раскрывать.
Открытый доступ: эта статья является статьей открытого доступа, которая была выбрана внутренним редактором и полностью проверена внешними рецензентами. Она распространяется в соответствии с лицензией Creative Commons Attribution Non Commercial (CC BY-NC 4.0), которая позволяет другим распространять, перерабатывать, адаптировать, строить на основе этой работы некоммерческие работы и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа должным образом цитируется и использование является некоммерческим. См.: http://creativecommons.org/licenses/by-nc/4.0/
Источник рукописи: приглашенная рукопись
Адрес для корреспонденции: Акбар Хан, доктор медицины, медицинский директор,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. akhan@medicorcancer.com
Телефон: +1-416-2270037
Факс: +1-416-2271915
Получено: 30 января 2017 г.
Начало рецензирования: 12 февраля 2017 г.
Первое решение: 28 марта 2017 г.
Исправлено: 5 мая 2017 г.
Принято: 30 мая 2017 г.
Статья в печати: 31 мая 2017 г.
Опубликовано онлайн: 10 августа 2017 г.
Абстрактный
Дихлорацетат натрия (DCA) изучается как метаболическая терапия рака с 2007 года на основе публикации Bonnet et al, демонстрирующей, что DCA может вызывать апоптоз (запрограммированную гибель клеток) в клетках рака молочной железы, легких и мозга человека. Классически реакция рака на медикаментозную терапию в исследованиях на людях измеряется с помощью определений Критериев оценки ответа для солидных опухолей, которые определяют «ответ» по степени уменьшения опухоли или исчезновения опухоли при визуализации, однако стабилизация заболевания также является полезным клиническим результатом. Было показано, что DCA может функционировать как цитостатический агент in vitro и in vivo, не вызывая апоптоза. Представлен случай 32-летнего мужчины, у которого терапия DCA без сопутствующей традиционной терапии привела к регрессии и стабилизации рецидивирующей метастатической меланомы в течение более 4 лет с незначительными побочными эффектами. Этот случай демонстрирует, что DCA можно использовать для уменьшения объема заболевания и поддержания долгосрочной стабильности у пациентов с запущенной меланомой.
Ключевые слова: Дихлорацетат; Рак; BRAF; Меланома; Цитостатики
© Автор(ы) 2017. Опубликовано Baishideng Publishing Group Inc. Все права защищены.
Основная подсказка: Дихлорацетат натрия (DCA) изучается как метаболическая терапия рака с 2007 года. Было показано, что терапия DCA может привести к классическому ответу, который измеряется уменьшением или исчезновением опухолей при визуализации. Однако DCA может также остановить рост раковых клеток, не вызывая апоптоза (цитостатический эффект). Это может привести к долгосрочной стабилизации метастатического рака. Мы представляем случай пероральной терапии DCA, которая привела к уменьшению и стабилизации метастатической меланомы у 32-летнего мужчины в течение более 4 лет, с небольшими побочными эффектами.
Хан А., Эндрюс Д., Шейнхаус Дж., Блэкберн А.К. Долгосрочная стабилизация метастатической меланомы с помощью дихлорацетата натрия.
World J Clin Oncol 2017; 8(4): 371-377
Доступно по адресу: URL: http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI: http://dx.doi.org/10.5306/wjco.v8.i4.371
ВВЕДЕНИЕ
Дихлорацетат натрия (DCA) привлек внимание медицинского сообщества в 2007 году, когда Боннет и др. опубликовали первое исследование in vitro и in vivo, иллюстрирующее ценность DCA как метаболической терапии рака посредством его ингибирующего действия на митохондриальный фермент пируватдегидрогеназу киназу. Ранее Стакпул и др. опубликовали несколько исследований DCA для лечения врожденного лактатацидоза при митохондриальных заболеваниях. Эти исследования показали, что пероральный DCA является безопасным препаратом для использования человеком. Было отмечено, что DCA не оказывает почечной, легочной, костномозговой и сердечной токсичности . Большинство побочных эффектов DCA были умеренными, причем наиболее серьезным из них была обратимая периферическая невропатия . Также сообщалось об обратимом делирии. Повышение уровня печеночных ферментов (бессимптомное и обратимое) было отмечено у небольшого процента пациентов. Предшествующие исследования митохондриальных расстройств на людях позволили быстро перевести DCA на использование человеком в качестве не по назначению терапии рака. В настоящее время опубликовано несколько отчетов о клинических испытаниях с использованием DCA в качестве терапии рака, подтверждающих его профиль безопасности и указывающих на растущее признание потенциальной полезности DCA в онкологической клинике . Одним из ограничений этих исследований с участием пациентов на поздней стадии является то, что они сообщали только о лечении в течение коротких периодов времени.
В публикации Бонне 2007 года было показано, что лечение DCA снижает потенциал митохондриальной мембраны, что селективно способствует апоптозу в раковых клетках человека. Ингибирование аэробного гликолиза (эффект Варбурга) и активация митохондриальных калиевых ионных каналов были идентифицированы как механизмы действия DCA. Дальнейшие исследования DCA in vitro подтвердили противораковую активность против широкого спектра типов рака, которые были недавно рассмотрены Канкотией и Стэкпулом . Кроме того, DCA также способен усиливать апоптоз в сочетании с другими агентами . Также были предложены другие противораковые действия DCA, включая ингибирование ангиогенеза , изменение экспрессии HIF1-α , изменение регуляторов pH клеток V-АТФазы и MCT1, а также других регуляторов выживания клеток, таких как p53 и PUMA . Однако во многих исследованиях in vitro используются неоправданно высокие концентрации DCA, которые клинически недостижимы, в попытке продемонстрировать цитотоксическую активность.. В других исследованиях использовались более скромные концентрации DCA, что показало, что DCA может быть цитостатическим. Во втором отчете 2010 года о его противораковой активности in vivo было обнаружено, что DCA сам по себе является цитостатическим в метастатической модели рака молочной железы , ингибируя пролиферацию, не вызывая апоптоз. Это предполагает роль DCA как стабилизатора рака, аналогичного ингибиторам ангиогенеза.
В ответ на отчет 2007 года о противораковом действии DCA Хан начал использовать DCA для лечения онкологических больных с коротким прогнозом или тех, кто перестал реагировать на традиционные методы лечения рака. В сотрудничестве с врачом-натуропатом (Эндрюс) был разработан протокол натурального лечения для решения проблемы ограничивающей дозу неврологической токсичности DCA. Он состоял из 3 лекарств: ацетил L-карнитин , R-альфа-липоевая кислота и бенфотиамин для профилактики нейропатии и энцефалопатии. У более чем 300 пациентов с поздней стадией рака наблюдательные данные показали, что терапия DCA принесла пользу в 60% -70% случаев. Риск нейропатии при сочетании натуральных нейропротекторных лекарств с DCA составлял приблизительно 20% при дозировке 20-25 мг/кг в день в течение 2 недель приема/1 недели перерыва (клинические наблюдательные данные опубликованы онлайн на сайте www.medicorcancer.com). Здесь представлен отчет о случае пациента, иллюстрирующий как апоптотический, так и антипролиферативный эффект хронического лечения DCA в течение более четырех лет.
ОТЧЕТ О ДЕЛЕ
32-летний ранее здоровый светлокожий мужчина изначально заметил, что родинка на его левой икре начала меняться в 2006 году. Он обратился к врачу, и родинка была удалена. Был поставлен патологический диагноз меланомы. Была проведена диссекция сторожевого узла, которая оказалась отрицательной на метастатическое заболевание. В 2007 году пациент отметил увеличение левых паховых лимфатических узлов и небольшие меланоцитарные поражения на коже левой ноги. Он прошел лечение интерфероном альфа в рамках клинического испытания в региональной онкологической больнице, что привело к уменьшению узлов и разрешению кожных метастазов. Интерферон был отменен через 9 месяцев из-за побочных эффектов.
Пациент оставался в хорошем состоянии до 2010 года, когда появился новый кожный метастаз левой ноги. Он был хирургически удален. В конце 2011 года был обнаружен еще один новый кожный метастаз на левой ноге в рубце от первоначальной операции по удалению меланомы. Была проведена биопсия, и был подтвержден диагноз рецидивирующей меланомы. Затем ему сделали широкое иссечение и пересадку кожи.
В марте 2012 года у пациента диагностировали рецидив в кожном лоскуте левой ноги. Он был иссечен, и была проведена новая процедура пересадки кожи. Патология выявила положительные края иссеченного метастаза, поэтому была проведена повторная резекция, снова с положительными краями. В то же время игольчатая биопсия левого пахового лимфатического узла подтвердила наличие BRAF-положительной метастатической меланомы. Компьютерная томография (КТ), проведенная в марте 2012 года, не выявила никаких признаков отдаленных метастазов. Самый большой левый паховый узел имел диаметр 8 мм, что было сообщено как «незначительный по критериям размера» (рисунок 1).
В апреле 2012 года пациент обратился к врачу-натуропату (Shainhouse) и начал терапию следующими пероральными натуральными противораковыми средствами: активное гексозо-коррелированное соединение или AHCC (экстракт гриба) , корень одуванчика , куркумин и корень астрагала . Также была начата парентеральная терапия, которая состояла из внутривенного витамина С два раза в неделю и подкожного экстракта омелы европейской. Пациент также перешел на веганскую диету.
В мае 2012 года пациент посетил клинику автора (Khan), желая получить дополнительные нетрадиционные методы лечения. Обсуждалась терапия DCA, но пациент решил сначала провести адекватную пробу натуральных противораковых методов лечения (прописанных Shainhouse). В мае 2012 года была проведена повторная КТ (всего через 1 месяц естественной терапии), которая выявила умеренное увеличение множественных паховых и наружных подвздошных узлов размерами от 10 мм × 11 мм до 14 мм × 15 мм.
В июле 2012 года КТ-сканирование было повторено для оценки естественной противораковой терапии пациента. В то время левые паховые и наружные подвздошные узлы снова увеличились и имели размер от 13 мм × 16 мм до 22 мм × 20 мм (рисунок 2). ПЭТ-сканирование также было проведено в рамках подготовки к участию в клиническом исследовании в Бостоне, штат Массачусетс (США), и подтвердило повышенное поглощение глюкозы в левых паховых узлах. Появилась новая слабая (2/10) ноющая боль в левой паховой области. Обследование выявило 20-миллиметровый безболезненный левый паховый лимфатический узел и два небольших кожные метастаза в пределах кожного трансплантата левой голени.
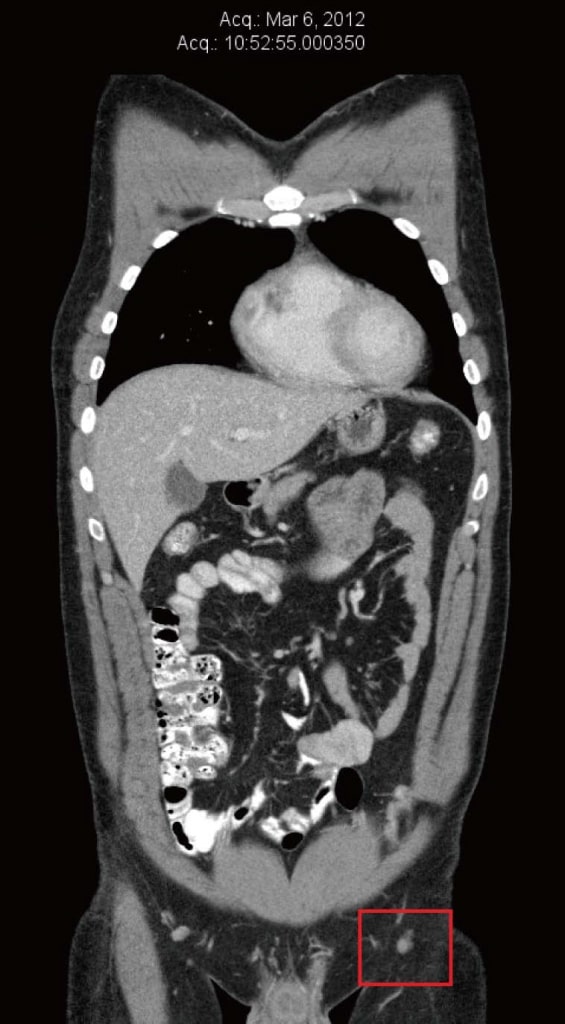 Рисунок 1. Компьютерная томография от марта 2012 г. до естественной терапии и до терапии дихлорацетатом. Самый большой узел имел диаметр 8 мм.
Рисунок 1. Компьютерная томография от марта 2012 г. до естественной терапии и до терапии дихлорацетатом. Самый большой узел имел диаметр 8 мм.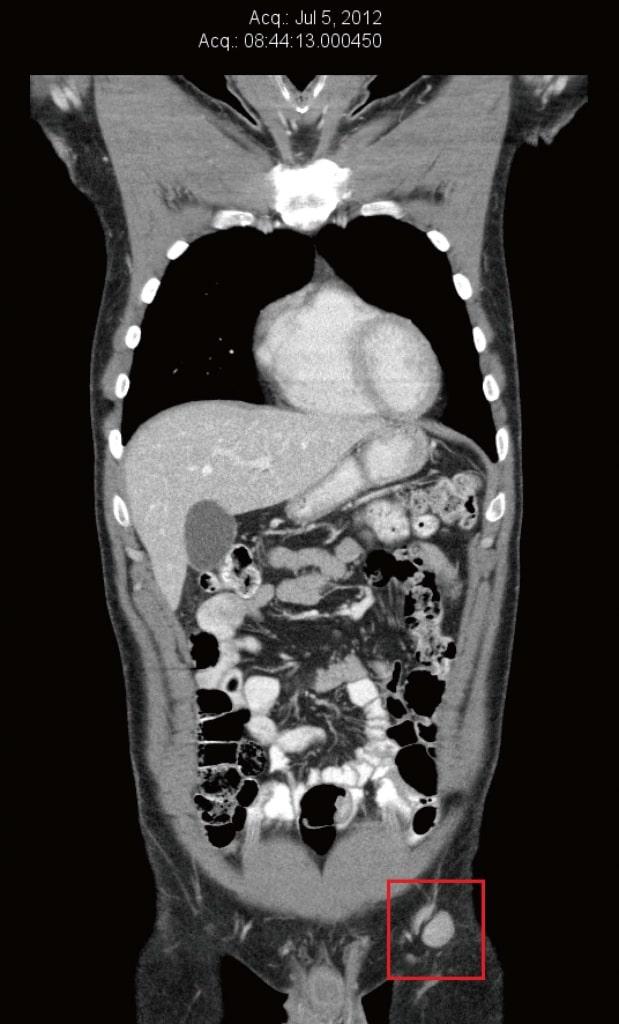 Рисунок 2. Компьютерная томография от июля 2012 г. после 3 месяцев только естественной терапии, непосредственно перед началом терапии дихлорацетатом. Самый большой узел имел размеры 22 мм × 20 мм.
Рисунок 2. Компьютерная томография от июля 2012 г. после 3 месяцев только естественной терапии, непосредственно перед началом терапии дихлорацетатом. Самый большой узел имел размеры 22 мм × 20 мм.
Таким образом, у пациента диагностировали прогрессирование заболевания. В этот момент он решил начать терапию DCA. Он начал принимать DCA перорально по 500 мг 3 раза в день, что было эквивалентно 17 мг/кг в день (производитель: Tokyo Chemical Industry, США) в дополнение к поддержанию других натуральных методов лечения. Цикл лечения DCA составлял 2 недели приема и 1 неделю перерыва. Чтобы свести к минимуму возникновение побочных эффектов DCA, были назначены 3 дополнительных натуральных препарата: пероральный ацетил L-карнитин по 500 мг 3 раза в день, пероральный бенфотиамин по 80 мг два раза в день и пероральная R-альфа-липоевая кислота по 150 мг 3 раза в день. Эти добавки принимались ежедневно (без цикла). Были проведены рутинные базовые анализы крови (таблица 1). Все они были в норме, за исключением низкого уровня креатинина, который считался незначительным.
В ноябре 2012 года, через 4 месяца после добавления DCA к его первоначальной естественной противораковой терапии, пациент прошел повторную оценку. Он чувствовал себя в целом хорошо. Было сообщено, что два новых симптома начались только после начала терапии DCA: слегка сниженная чувствительность кончиков пальцев рук и ног и слегка сниженная способность концентрироваться в течение 2 недель, в течение которых он принимал DCA. Легкая потеря чувствительности не ухудшалась и ощущалась как легкая невропатия, связанная с DCA. Сообщалось, что как онемение, так и снижение концентрации прошли в течение недель, когда пациент не принимал DCA. Анализ крови от октября 2012 года не показал существенных изменений (таблица 1). КТ в августе 2012 года и ноябре 2012 года выявили значительную регрессию всех ранее увеличенных лимфатических узлов. Самый большой узел был 10 мм, и не было никаких признаков внутригрудного или внутрибрюшного заболевания, а также никаких метастазов в кости (рисунок 3).
Пациент продолжал чувствовать себя хорошо на терапии DCA и не заметил никаких новых метастазов в коже или нового увеличения паховых узлов. Он продолжал проходить частый клинический мониторинг у своего врача-натуропата (Шейнхаус) и ежегодное последующее наблюдение у своего лечащего врача (Хан). Перечисленные натуральные противораковые терапии (назначенные Шейнхаусом) и терапия DCA продолжались до 2016 года. Результаты анализа крови в июне 2016 года продолжали быть нормальными (таблица 1). КТ была повторена в августе 2016 года, не показав никаких признаков метастатической меланомы, после полных 4 лет непрерывной терапии DCA в сочетании с натуральной противораковой терапией (рисунок 4). К декабрю 2016 года пациент сообщил об увеличении стресса, связанного с работой, и снижении соблюдения режима приема лекарств. В то время он заметил новую паховую массу слева. Была получена ультразвуковая визуализация, которая выявила новый конгломерат увеличенных лимфатических узлов размером 40 мм × 25 мм × 23 мм, с цветным допплером, показывающим кровоток внутри массы. Это было интерпретировано как повторный рост меланомы, примерно после четырех с половиной лет непрерывной терапии DCA. Было проведено дальнейшее обследование, включая ПЭТ/КТ, которое подтвердило рецидив заболевания в 3 левых паховых узлах (SUV max в диапазоне от 13 до 17,8).
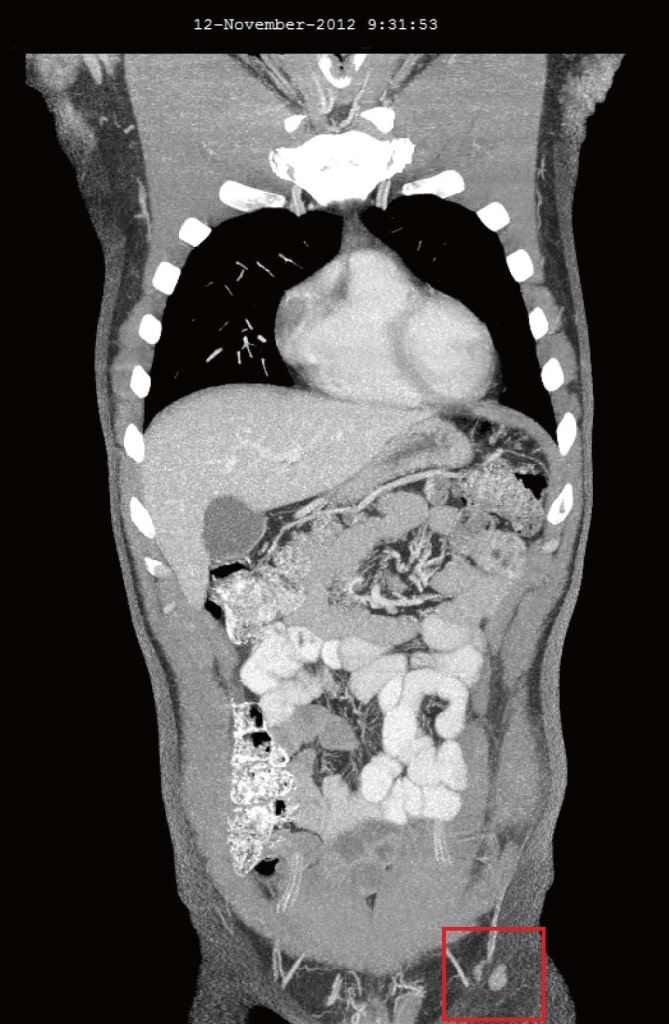 Рисунок 3. Компьютерная томография от ноября 2012 г. после 4 месяцев терапии дихлорацетатом. Самый большой узел размером 10 мм.
Рисунок 3. Компьютерная томография от ноября 2012 г. после 4 месяцев терапии дихлорацетатом. Самый большой узел размером 10 мм.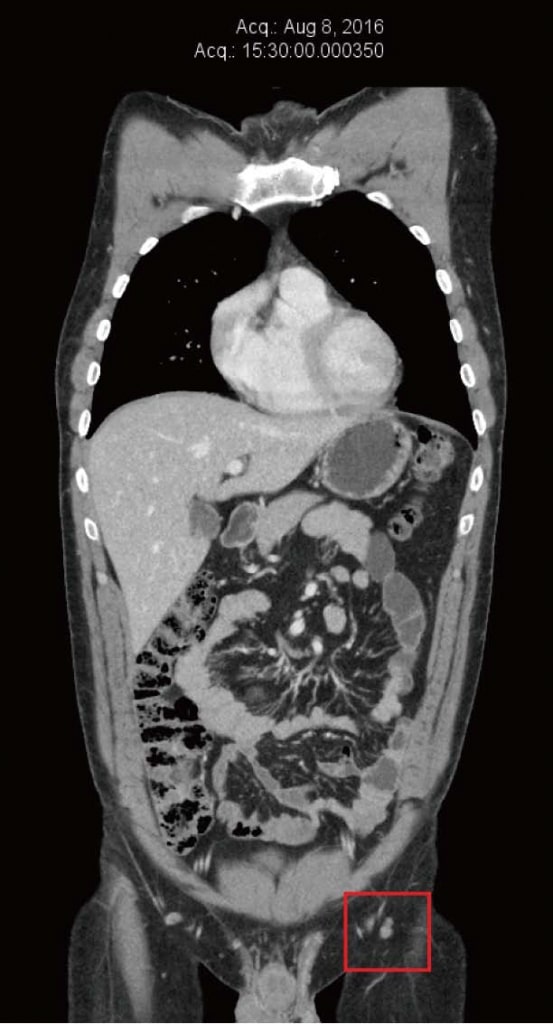 Рисунок 4. Компьютерная томография после 4 лет терапии дихлорацетатом без сопутствующих традиционных методов лечения рака. Сканирование показывает отсутствие повторного роста рака. Все узлы имеют размер менее 10 мм.
Рисунок 4. Компьютерная томография после 4 лет терапии дихлорацетатом без сопутствующих традиционных методов лечения рака. Сканирование показывает отсутствие повторного роста рака. Все узлы имеют размер менее 10 мм.
Вкратце, пациент получал традиционную терапию рецидивирующей меланомы 3 стадии в течение 6 лет, состоящую из первичной хирургической резекции с лимфодиссекцией, интерферона альфа и хирургической резекции рецидивирующих кожных метастазов 5 раз. Затем пациент получал только естественную противораковую терапию (назначенную Шейнхаусом) в течение 3 месяцев без ответа, о чем свидетельствовало устойчивое прогрессирование заболевания на серийных КТ-сканированиях. Наконец, пациент добавил пероральную терапию DCA к естественной противораковой терапии с 3 сопутствующими нейропротекторными препаратами (липоевая кислота, ацетил L-карнитин и бенфотиамин) и без сопутствующих традиционных методов лечения рака. Результатом стала полная радиологическая ремиссия, продолжавшаяся более 4 лет, за которой последовал рецидив. Во время курса терапии DCA у пациента наблюдались незначительные побочные эффекты, состоящие из легкой невропатии и небольшого снижения концентрации. У пациента сохранялась функция ECOG уровня 0, и он мог работать полный рабочий день.
Таблица 1 Анализ крови до терапии дихлорацетатом натрия
| Анализ крови | 12 июля до DCA | 12 октября 3 мес. DCA | 16 июня 4 года DCA | Единицы | Нормальный диапазон |
|---|---|---|---|---|---|
| Гемоглобин | 154 | 150 | 157 | г/л | 135-175 |
| Количество лейкоцитов | 4.5 | 4.1 | 5 | × 10 9 /л | 4.0-11.0 |
| Тромбоциты | 220 | 214 | 229 | × 10 9 /л | 150-400 |
| Глюкоза | – | 4.6 | 4.9 | ммоль/л | 3.6-7.7 |
| Мочевина | 3.9 | 3.2 | 3.9 | ммоль/л | 2,5-8,0 |
| Креатинин | 49 1 | 50 1 | 55 1 | мкмоль/л | 62-115 |
| Кальций | 2.47 | 2.41 | 2.47 | ммоль/л | 2.15-2.60 |
| Альбумин | 48 | 45 | 47 | г/л | 35-50 |
| Билирубин | 8 | 10 | 13 | мкмоль/л | < 22 |
| Натрий | 139 | 141 | 140 | ммоль/л | 135-147 |
| Калий | 4 | 4.3 | 3.9 | ммоль/л | 3,5-5,5 |
| Хлористый | 106 | 107 | 105 | ммоль/л | 100-110 |
| Щелочная фосфатаза | 77 | 69 | 71 | У/л | 45-129 |
| ЛДГ | 139 | 135 | 144 | У/л | 120-246 |
| ГГТ | 18 | 19 | 20 | У/л | 15-73 |
| АСТ | 18 | 25 | 21 | У/л | 7-37 |
| АЛЬТ | 18 | 28 | 19 | У/л | 12-49 |
1 Указывает на аномальное значение. DCA: Дихлорацетат; LDH: Лактатдегидрогеназа; GGT: Гамма-глутамилтрансфераза; AST: Аспартатаминотрансфераза; ALT: Аланинаминотрансфераза.
ОБСУЖДЕНИЕ
Использование перорального DCA у пациента с метастатической меланомой, описанное здесь, демонстрирует уменьшение опухоли и долгосрочную стабильность заболевания в соответствии с клиническим статусом и КТ-визуализацией. Стабильность заболевания сохранялась более 4 лет при приеме DCA в отсутствие какой-либо сопутствующей традиционной терапии, с выживаемостью с момента первоначальной постановки диагноза 10 лет. Согласно статистике рака SEER Национального института рака, выживаемость этого пациента, у которого не было признаков отдаленных метастазов, не является примечательной (62,9% 5-летняя выживаемость при меланоме с распространением на региональные лимфатические узлы, https://seer.cancer.gov/statfacts/html/melan.html). Примечательно то, что в ситуации, когда вовлеченные лимфатические узлы явно увеличивались, добавление пероральной терапии DCA было эффективным для уменьшения увеличивающихся узлов (рисунки 2 и 3) и достижения ремиссии, продолжавшейся более 4 лет. Возможно, что естественные противораковые терапии, которые получал пациент, синергизировались с DCA, но также очевидно, что эти естественные терапии сами по себе не могут объяснить регрессию заболевания. Сообщалось, что DCA оказывает как апоптотический, так и цитостатический эффект, что согласуется с клиническим течением регрессии (апоптотический) и длительной ремиссией (цитостатический) у этого пациента. Рецидив через 4 года совпал с уменьшением соблюдения режима лечения, что предполагает, что этот метод лечения рака с помощью DCA требует постоянного поддержания метаболического давления. Несмотря на рецидив, пациент оставался клинически здоровым и планировал начать прием новых иммунотерапевтических препаратов. Еще предстоит выяснить, сможет ли изменение терапии снова достичь регрессии или стабильности заболевания.
Помимо поддержания ремиссии в течение более 4 лет, этот случай иллюстрирует, что DCA может хорошо переноситься онкологическим пациентом в течение длительного периода времени по сравнению со всеми опубликованными клиническими испытаниями DCA по раку. Примечательно, что этот пациент смог переносить 17 мг/кг в день в режиме 2 недели приема/1 неделя перерыва в течение 4 лет с минимальными побочными эффектами. Это похоже на наш предыдущий отчет о случае хронического использования DCA при раке толстой кишки , где пациент смог переносить 16 мг/кг в день (но не 25 мг/кг в день) в том же режиме, но контрастирует с клиническими испытаниями DCA, которые рекомендуют более низкую дозу 10-12,5 мг/кг в день, вводимую непрерывно. Перерыв в 1 неделю или нейропротекторные добавки могут способствовать способности пациентов в отчетах о случаях переносить более высокую дозу. Генетические полиморфизмы в GSTZ1, ферменте печени, который метаболизирует DCA, также могут способствовать дозе DCA, которая может быть переносима. В испытаниях сообщалось о различных уровнях препарата, но не все из них рассматривали этот фармакогенетический аспект терапии DCA , и необходимы дальнейшие исследования, чтобы выяснить, является ли это существенным фактором переносимости DCA. На момент написания этой статьи продолжается исследование DCA с множественной миеломой у людей, в котором изучаются как генотипы GSTZ1, так и уровни препарата, чтобы внести свой вклад в наше понимание этих проблем (Реестр клинических испытаний Австралии и Новой Зеландии #ACTRN12615000226505, http://www.anzctr.org.au).
Этот отчет о случае показывает, что хроническая терапия DCA может использоваться без снижения качества жизни по сравнению с традиционными методами лечения меланомы, такими как интерферон. Чтобы определить оптимальный протокол для максимально переносимого острого или хронического лечения с помощью DCA, необходимы испытания на людях. Но что еще важнее, все еще остается выяснить, какая доза требуется для целевых эффектов, которые будут эффективны против рака. Эта информация необходима перед инвестированием в более крупные долгосрочные исследования результатов для пациентов. DCA заслуживает дальнейшего изучения в клинических испытаниях как нетоксичная терапия рака из-за своей скромной стоимости и низкой токсичности, а также заслуживает рассмотрения в качестве терапии рака не по назначению.
БЛАГОДАРНОСТИ
Авторы хотели бы поблагодарить доктора Хумайру Хан за ее помощь, а также пациентку за ее поддержку и согласие опубликовать ее случай.
КОММЕНТАРИИ
Характеристика случая
У 32-летнего мужчины на ноге обнаружилось пигментное пятно.
Клинический диагноз
У пациентки диагностирована меланома.
Лабораторный диагноз:
Меланома подтверждена эксцизионной биопсией.
Диагностика с помощью визуализации:
подтверждено наличие увеличенного пахового узла в меланоме (биопсия иглой).
Патологический диагноз:
Меланома, BRAF-положительный.
Лечение
Иссечение первичного очага с пересадкой кожи, иссечение сторожевого узла, множественные иссечение рецидивирующих кожных метастазов. Традиционная терапия прекращена и начаты натуральные противораковые терапии (AHCC, корень одуванчика, куркумин, корень астрагала, внутривенно витамин С, подкожно европейская омела). Прогрессирование через 3 месяца, добавлен дихлорацетат (DCA). Регресс и ремиссия после добавления DCA, продолжающиеся более 4 лет.
Сопутствующие отчеты
Отчеты компьютерной томографии демонстрируют течение заболевания и реакцию на терапию.
Объяснение термина
DCA: Дихлорацетат натрия; RECIST: Критерии оценки ответа на солидные опухоли; ECOG: Восточная кооперативная онкологическая группа; SEER: Наблюдение, эпидемиология и конечные результаты.
Опыт и уроки
DCA может действовать как проапоптотический и цитостатический препарат и, таким образом, может достигать регрессии, а также долгосрочной стабилизации метастатического рака без серьезных побочных эффектов, как показано на примере этого случая меланомы.
Рецензирование
Доктор Хан описал 32-летнего мужчину, который получал терапию DCA с другими препаратами от натуропатов и поддерживался в состоянии стабилизации (метастатическая меланома) более 4 лет. Это интересный случай.
ССЫЛКИ
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. Ось митохондриального канала K+ подавляется при раке, а ее нормализация способствует апоптозу и подавляет рост рака. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Роль дихлорацетата в лечении генетических митохондриальных заболеваний. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Оценка длительного лечения детей с врожденным лактоацидозом дихлорацетатом. Педиатрия 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O'Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Контролируемое клиническое исследование дихлорацетата для лечения врожденного лактоацидоза у детей. Педиатрия 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Терапевтический потенциал дихлорацетата при дефиците пируватдегидрогеназного комплекса. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Дихлорацетат вызывает токсическую невропатию при MELAS: рандомизированное контролируемое клиническое исследование. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Тяжелая энцефалопатия и полинейропатия, вызванная дихлорацетатом. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Микелакис Э.Д., Сутендра Г., Дромпарис П., Вебстер Л., Хароми А., Нивен Э., Магуайр К., Гаммер Т.Л., Макки Дж.Р., Фултон Д., Абдулкарим Б., Макмертри М.С., Петрук К.С. Метаболическая модуляция глиобластомы дихлорацетатом. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Данбар EM, Коутс BS, Шроудс AL, Лангаи T, Лью A, Фордер JR, Шустер JJ, Вагнер DA, Стэкпул PW. Фаза 1 испытания дихлорацетата (DCA) у взрослых с рецидивирующими злокачественными опухолями мозга. Invest New Drugs2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/ s10637-013-0047-4]
10Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Дихлорацетат следует рассматривать с химиотерапией на основе платины при гипоксических опухолях, а не как единственный агент при распространенном немелкоклеточном раке легких. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Открытое исследование фазы I с однокомпонентным методом и повышением дозы дихлорацетата (DCA) у пациентов с запущенными солидными опухолями. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Канкотия С., Стэкпул П. У. Дихлорацетат и рак: новый дом для орфанного препарата? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
13 Сан Р. К., Борд П. Г., Блэкберн А. К. Нацеливание метаболизма с помощью триоксида мышьяка и дихлорацетата в клетках рака молочной железы. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Дихлорацетат натрия селективно воздействует на клетки с дефектами в митохондриальной ЭТЦ. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Нацеливание на два аспекта метаболизма при лечении рака молочной железы. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Активация митохондрий путем ингибирования PDKII подавляет сигнализацию HIF1a и ангиогенез при раке. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. Фармакологически повышенная гипоксия опухоли может быть измерена с помощью позитронно-эмиссионной томографии с 18F-фторазомицин арабинозидом и усиливает реакцию опухоли на гипоксический цитотоксин PR-104. Clin Cancer Res 2009; 15: 7170-7174 [PMID: 19920111 DOI: 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro эффекты дихлорацетата и CO2 на гипоксические клетки HeLa. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Изменение гликолитического фенотипа дихлорацетатом подавляет рост метастатических клеток рака молочной железы in vitro и in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/ s10549-009-0435-9]
20De Grandis D. Ацетил-L-карнитин для лечения периферической нейропатии, вызванной химиотерапией: краткий обзор. CNS Drugs 2007; 21 Suppl 1: 39-43; обсуждение 45-46 [PMID: 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. Пилотное исследование эффекта ацетил-L-карнитина при периферической нейропатии, вызванной паклитакселом и цисплатином. Tumori 2005; 91: 135-138 [PMID: 15948540]
22 Evans JD, Jacobs TF, Evans EW. Роль ацетил-L-карнитина в лечении диабетической периферической нейропатии. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Альфа-липоевая кислота при симптоматической периферической нейропатии у пациентов с диабетом: метаанализ рандомизированных контролируемых исследований. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Лечебный эффект альфа-липоевой кислоты на периферическую нейропатию при диабете 2 типа: клиническое исследование]. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Лечение симптоматической диабетической периферической нейропатии антиоксидантной альфа-липоевой кислотой. 3-недельное многоцентровое рандомизированное контролируемое исследование (исследование ALADIN). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
26 Winkler G, Kempler P. [Патомеханизм диабетической нейропатии: предпосылки патогенез-ориентированной терапии]. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Витамин B для лечения периферической нейропатии. Cochrane Database Syst Rev 2008; (3): CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Эффективность различных режимов дозировки бенфотиамина при лечении болезненной диабетической невропатии. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Терапевтический эффект активного гексозо-коррелированного соединения (AHCC) в сочетании с CpG-ODN (олигодезоксинуклеотидом) в мышиной модели меланомы B16. Cytokine 2015; 76: 131-137 [PMID: 26082022 DOI: 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. Эффективность экстракта корня одуванчика в индукции апоптоза в клетках меланомы человека, устойчивых к лекарственным препаратам. Evid Based Complement Alternat Med 2011; 2011: 129045 [PMID: 21234313 DOI: 10.1155/2011/129045]
31Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Куркумин: новый кандидат для терапии меланомы? Int J Cancer 2016; 139: 1683-1695 [PMID: 27280688 DOI: 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Повышение противоопухолевой эффективности при комбинированном применении астрагала и птеростильбена при меланоме. Asian Pac J Cancer Prev 2014; 15: 1163-1169 [PMID: 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. Внутривенная аскорбиновая кислота как адъювант иммунотерапии интерлейкином-2. J Transl Med 2014; 12: 127 [PMID: 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Терапия омелой в онкологии. Cochrane Database Syst Rev 2008; (2): CD003297 [PMID: 18425885 DOI: 10.1002/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Дихлорацетат влияет на пролиферацию, но не на выживаемость клеток колоректального рака человека. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. Биоэнергетическая модуляция с помощью дихлорацетата снижает рост клеток меланомы и усиливает их ответ на ингибирование BRAFV600E. J Transl Med 2014; 12: 247 [PMID: 25182332 DOI: 10.1186/s12967-014-0247-5]
37 Хан А., Эндрюс Д., Блэкберн А. С. Долгосрочная стабилизация рака толстой кишки 4 стадии с использованием терапии дихлорацетатом натрия. World J Clin Cases 2016; 4: 336-343 [PMID: 27803917]
38 Ценг Х. Ф., Блэкберн А. С., Борд П. Г., Андерс М. В. Полиморфизм и зависящая от вида инактивация дзета-глутатионтрансферазы дихлорацетатом. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]
Дихлорацетат (ДХА) и рак: обзор клинического применения
Дихлорацетат (ДХА) и рак: обзор клинического применения
Лаборатория доклинических и трансляционных исследований, IRCCS-CROB, Реферальный онкологический центр Базиликаты, Рионеро-ин-Вультуре (Pz), 85028, Италия
2 Кафедра клинической и экспериментальной медицины, Университет Фоджи, Фоджа 71121, Италия
Корреспонденцию следует направлять Тициане Татарани; tiziana.tataranni@crob.it
Приглашенный редактор: Канхайя Сингх
Авторские права © 2019 Тициана Татаранни и Клаудия Пикколи. Это статья открытого доступа, распространяемая по лицензии Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Получено: 24 июля 2019 г.
Изменено: 12 сентября 2019 г.
Принято: 11 октября 2019 г.
Опубликовано онлайн: 14 ноября 2019 г.
Обширный объем литературы описывает противораковые свойства дихлорацетата (DCA), но его эффективное клиническое применение в терапии рака по-прежнему ограничивается клиническими испытаниями. Возникновение побочных эффектов, таких как нейротоксичность, а также подозрение на канцерогенность DCA по-прежнему ограничивают клиническое применение DCA. Однако в последние годы число отчетов, поддерживающих использование DCA против рака, возросло также из-за большого интереса к нацеливанию на метаболизм опухолевых клеток. Анализ механизма действия DCA помог понять основы его селективной эффективности против раковых клеток. Успешное совместное введение DCA с традиционной химиотерапией, радиотерапией, другими препаратами или природными соединениями было протестировано на нескольких моделях рака. Новые системы доставки лекарств и многофункциональные соединения, содержащие DCA и другие препараты, по-видимому, улучшают биодоступность и кажутся более эффективными благодаря синергетическому действию нескольких агентов. Распространение отчетов, поддерживающих эффективность DCA в терапии рака, побудило провести дополнительные исследования, которые позволили найти другие потенциальные молекулярные мишени DCA. Интересно, что DCA может существенно влиять на фракцию стволовых клеток рака и способствовать искоренению рака. В совокупности эти результаты дают весомое обоснование для новых клинических трансляционных исследований DCA в терапии рака.
ВВЕДЕНИЕ
Рак является одной из основных причин смерти во всем мире. Несмотря на значительный прогресс в диагностических и терапевтических подходах, его искоренение по-прежнему представляет собой проблему. Слишком много факторов ответственны за неудачу терапии или рецидив, поэтому существует острая необходимость в поиске новых подходов к его лечению. Помимо типичных известных свойств, характерных для злокачественных клеток, включая аномальную пролиферацию, дерегуляцию апоптоза и клеточного цикла [1, 2] , раковые клетки также демонстрируют особую метаболическую машину, которая предлагает еще один многообещающий подход к терапии рака [3–5] . Наша группа уже предположила важность метаболической характеристики раковых клеток для прогнозирования эффективности метаболического лечения [6] . Лекарства, способные влиять на метаболизм рака, уже рассматриваются, показывая обнадеживающие результаты с точки зрения эффективности и переносимости [7] . В последнее десятилетие малая молекула DCA, уже используемая для лечения острого и хронического лактоацидоза, врожденных ошибок митохондриального метаболизма и диабета [8] , в основном предназначалась в качестве противоракового препарата. DCA представляет собой водорастворимую молекулу кислоты массой 150 Да, аналог уксусной кислоты, в которой два из трех атомов водорода метильной группы заменены атомами хлора (рисунок 1(a)) [9] . Введение DCA в дозах от 50 до 200 мг/кг/умер связано с уменьшением объема опухолевой массы, скорости пролиферации и распространения метастазов в нескольких доклинических моделях [10] . Наша группа уже наблюдала обратную корреляцию между способностью DCA убивать раковые клетки и их митохондриальной дыхательной способностью в карциномах ротовых клеток [11] . Более того, недавно мы описали способность DCA влиять на митохондриальную функцию и замедлять прогрессирование рака в модели рака поджелудочной железы [12] . На сегодняшний день доступны последовательные данные клинических испытаний и отчеты о случаях, описывающие введение DCA у онкологических больных [13–16] , но, несмотря на растущий объем литературы, подтверждающей эффективность DCA против рака, он пока не используется в клинической практике. Целью этого обзора является обобщение последних отчетов, предполагающих использование DCA в терапии рака в сочетании с химиотерапевтическими агентами, радиотерапией и другими химическими или природными соединениями, демонстрирующими противораковые свойства. Кроме того, мы описали данные о новых целевых фармакологических формулах DCA, способных избегать побочных эффектов и улучшать биодоступность и эффективность препарата, что еще больше поощряет его возможное клиническое применение. Наконец, мы рассмотрели последние результаты, предполагающие другие потенциальные механизмы действия DCA, включая новые данные о его способности влиять на фракцию стволовых клеток рака.
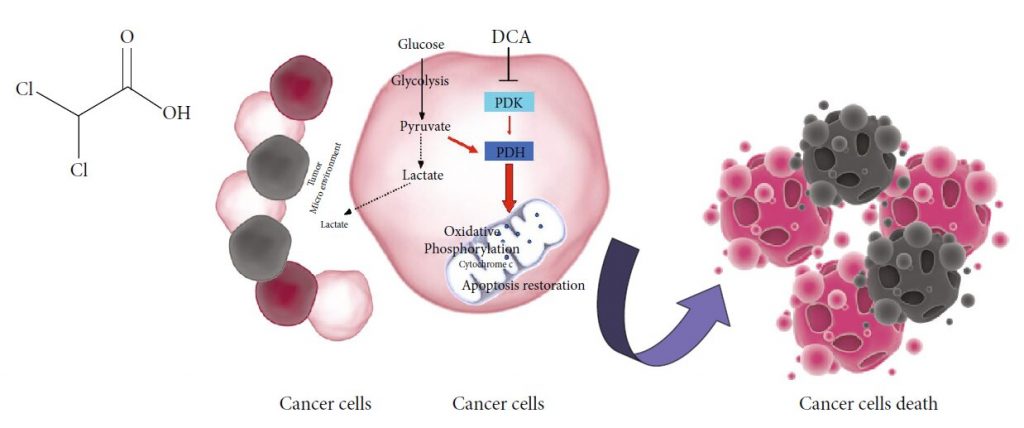 Рисунок 1: (a) Химическая структура DCA. (b) Механизм действия DCA: PDK: пируватдегидрогеназная киназа; PDH: пируватдегидрогеназа. Черные пунктирные линии — биохимические процессы, ингибируемые DCA; Красные стрелки — метаболические пути, активируемые DCA.
Рисунок 1: (a) Химическая структура DCA. (b) Механизм действия DCA: PDK: пируватдегидрогеназная киназа; PDH: пируватдегидрогеназа. Черные пунктирные линии — биохимические процессы, ингибируемые DCA; Красные стрелки — метаболические пути, активируемые DCA.
DCA и рак: механизм действия
Потенциальная эффективность DCA в терапии рака обусловлена метаболическими свойствами раковых клеток, которые обычно характеризуются повышенной гликолитической активностью и сниженным митохондриальным окислением независимо от доступности кислорода, хорошо известный эффект Варбурга [17] . Чрезмерный гликолиз и возникающее в результате перепроизводство лактата вызывают состояние метаболического ацидоза в микроокружении опухоли [ 18] . Лактат, образующийся в результате гликолиза, поглощается окружающими клетками для поддержки роста опухоли и ингибирует механизмы апоптотической гибели клеток [19, 20] . Несколько ферментов, участвующих в гликолизе, регулируют апоптоз, и их сверхэкспрессия в раковых клетках способствует подавлению апоптоза [21] . В этой ситуации соли DCA избирательно воздействуют на раковые клетки, переключая их метаболизм с гликолиза на окислительное фосфорилирование путем ингибирования киназы пируватдегидрогеназы (PDK), ингибитора пируватдегидрогеназы (PDH) [10] . Активация PDH способствует митохондриальному окислению пирувата и нарушает метаболическое преимущество раковых клеток. Мутации митохондриальной ДНК, часто возникающие при опухолеобразовании и приводящие к дисфункции дыхательной цепи [22, 23] , делают злокачественные клетки неспособными поддерживать клеточную потребность в энергии. Кроме того, снижая выработку лактата, DCA противодействует ацидозному состоянию микроокружения опухоли, способствуя ингибированию роста опухоли и ее распространению [24] . Доставка пирувата в митохондрии вызывает ремоделирование органелл, что приводит к увеличению оттока цитохрома c и других факторов, индуцирующих апоптоз, и повышению уровня ROS с последующим снижением жизнеспособности раковых клеток [9] (рисунок 1(b)).
Побочные эффекты и ограничения при использовании DCA
Клиническое применение DCA доступно как в пероральных, так и в парентеральных формулах, а дозы варьируются от 10 до 50 мг/кг/смерть [25] . Никакие доказательства тяжелой гематологической, печеночной, почечной или сердечной токсичности не подтверждают безопасность DCA [26] . Распространенные желудочно-кишечные побочные эффекты часто возникают у определенного процента пациентов, получавших лечение DCA [15] . Наиболее известным ограничением для введения DCA, наблюдавшимся как в доклинических, так и в клинических исследованиях, является периферическая невропатия [27] . Избирательность повреждения нервной системы, вызванного DCA, может быть связана с отсутствием хорошо оснащенного аппарата, способного справиться с более устойчивым окислительным фосфорилированием в клетках, продуцирующих АТФ в основном посредством гликолиза [28] . Возникающая в результате перегрузка митохондрий ставит под угрозу эффективность антиоксидантных систем, неспособных противостоять чрезмерному количеству ROS. В этой ситуации современное введение антиоксидантов должно представлять собой дополнительную стратегию для минимизации невропатии, вызванной DCA [27] . Экспрессия и активность глутатионтрансферазы zeta1 (GSTZ1), первого фермента, ответственного за клиренс DCA, могут влиять на сущность повреждения. Несинонимичные функциональные однонуклеотидные полиморфизмы (SNP) в гене человека GSTZ1 приводят к появлению различных гаплотипов, которые отвечают за различную кинетику и динамику DCA. Была продемонстрирована четкая связь между гаплотипом GSTZ1 и клиренсом DCA. На этой основе персонализированная дозировка DCA, основанная не только на массе тела, может минимизировать или предотвратить побочные эффекты у пациентов, хронически принимающих этот препарат [29] . Возникновение нейропатии связано с хроническим пероральным приемом DCA и является обратимым эффектом, ограниченным временем лечения [30] . Внутривенный путь снижает, OH Cl Cl O (a) Раковые клетки Раковые клетки Смерть раковых клеток Лактат Опухоль Микросреда Лактат Пируват Гликолиз PDK DCA PDH Окислительное фосфорилирование Апоптоз восстановление Цитохром c Глюкоза (b) Рисунок 1: (a) Химическая структура DCA. (b) Механизм действия DCA: PDK: пируватдегидрогеназная киназа; PDH: пируватдегидрогеназа. Черные пунктирные линии, биохимические процессы, ингибируемые DCA; Красные стрелки, метаболические пути, активируемые DCA. 2 Окислительная медицина и клеточная продолжительность жизни, следовательно, потенциал нейротоксичности и позволяют достижению более высоких концентраций препарата обойти пищеварительную систему [13] .
Поскольку DCA входит в число побочных продуктов дезинфекции воды, обнаруженных в низких концентрациях в питьевой воде, его потенциальная канцерогенность находится на стадии оценки. Исследования, проведенные на мышах, связывают воздействие DCA в раннем возрасте с увеличением частоты возникновения гепатоцеллюлярных опухолей [31]. Вполне возможно, что постоянные изменения в метаболизме клеток, вызванные DCA, могут вызывать эпигенетические эффекты. Длительная индукция PDH и других окислительных путей, связанных с метаболизмом глюкозы, может способствовать увеличению активных форм кислорода и митохондриального стресса [27] . Однако в клинических исследованиях не сообщается о каких-либо доказательствах канцерогенного эффекта при введении DCA в терапии рака.
Синергетический эффект DCA и химиотерапевтических агентов
Комбинирование различных препаратов является общепринятой стратегией для получения синергического полезного эффекта в терапии рака, снижения дозировки препаратов, минимизации рисков токсичности и преодоления лекарственной устойчивости. Совместное введение DCA и традиционных химиотерапевтических агентов было предназначено и протестировано на нескольких моделях рака (таблица 1). Лечение DCA, по-видимому, повышает эффективность химиотерапии, вызывая биохимические и метаболические изменения, что приводит к значительным изменениям энергетического баланса раковых клеток. Исследование, проведенное при немелкоклеточном раке легких (НМРЛ), показало как in vitro, так и in vivo, что совместное введение DCA с паклитакселом повышает эффективность гибели клеток за счет ингибирования аутофагии [32] . Эффективная комбинация DCA и доксорубицина (DOX) была протестирована на клетках HepG2, продемонстрировав способность DCA нарушать клеточную антиоксидантную защиту, тем самым способствуя окислительному повреждению, в свою очередь, вызванному лечением DOX [33] . Существует сильная связь между сверхэкспрессией PDK и химиорезистентностью; таким образом, можно предположить, что ингибирование PDK может помочь повторно сенсибилизировать раковые клетки к препаратам. Сверхэкспрессия изоформы PDK2 была связана с резистентностью к паклитакселу при НМРЛ. Интересно, что комбинация DCA с паклитакселом была более эффективна в уничтожении резистентных клеток, чем лечение паклитакселом или DCA по отдельности [34] . Подобно НМРЛ, интересное исследование in vivo, проведенное при распространенном раке мочевого пузыря, показало повышенную экспрессию изоформы PDK4 при высокой степени злокачественности по сравнению с раком низкой степени злокачественности, а совместное лечение DCA и цисплатином значительно уменьшило объемы опухоли по сравнению с DCA или цисплатином по отдельности [35]. Недавнее исследование подтвердило способность DCA устранять химиорезистентность, связанную с PDK4, также при гепатоцеллюлярной карциноме человека (ГЦК) [36] .
| Опухолевая сущность | Модельная система | Препарат химиотерапии, вводимый совместно с DCA | Механизм действия | Исход | Ссылки |
| Рак легких | Линии клеток A549-H1975/модель ксенотрансплантата | Паклитаксел | Торможение аутофагии | Эффективная сенсибилизация к химиотерапии рака | [32] |
| Гепатокарцинома | Линия клеток HepG2 | Доксорубицин | Нарушение антиоксидантной защиты | Увеличение повреждения клеток из-за индукции окислительного стресса | [33] |
| Рак легких | Линия клеток A549 | Паклитаксел | Повышенная химиочувствительность за счет ингибирования PDK2 | Преодоление резистентности к паклитакселу | [34] |
| Рак мочевого пузыря | Клеточные линии HTB-9, HT-1376, HTB-5, HTB-4/модель ксенотрансплантата | Цисплатин | Повышенная химиочувствительность за счет ингибирования PDK4 | Увеличение гибели раковых клеток и потенциальные терапевтические преимущества | [35] |
| Гепатокарцинома | Сферические культуры из клеточных линий HepaRG и BC2 | Цисплатин, сорафениб | Повышенная химиочувствительность за счет ингибирования PDK4 | Улучшение терапевтического эффекта химиотерапии за счет восстановления активности митохондрий | [36] |
Таблица 1: Список отчетов, предполагающих положительный эффект совместного применения DCA и химиотерапии при нескольких типах рака.
Синергетический эффект DCA и других потенциальных противораковых препаратов
Последовательный объем литературы предполагает положительные эффекты совместного введения DCA с соединениями, которые в настоящее время используются для лечения других заболеваний, но демонстрируют противораковые свойства в нескольких моделях рака (таблица 2). Современное введение DCA и антибиотика салиномицина, недавно заново открытого за его цитотоксические свойства как потенциального противоракового препарата, было протестировано на линиях клеток колоректального рака. Их лечение, по-видимому, оказывает синергический цитотоксический эффект, ингибируя экспрессию белков, связанных с множественной лекарственной устойчивостью [37] . Раковые клетки, лишенные метаболических ферментов, участвующих в метаболизме аргинина, могут привести к чувствительности к лечению аргиназой. Интересно, что совместное введение рекомбинантной аргиназы и DCA оказывает антипролиферативный эффект при тройном негативном раке молочной железы из-за активации p53 и индукции остановки клеточного цикла [38] . Ингибиторы COX2, в основном используемые в качестве противовоспалительных препаратов, недавно были предложены в качестве противоопухолевых препаратов из-за их антипролиферативной активности. Интригующее исследование, проведенное на клетках рака шейки матки, показало неспособность DCA убивать клетки рака шейки матки, сверхэкспрессирующие COX2, и продемонстрировало, что ингибирование COX2 целекоксибом делает клетки рака шейки матки более чувствительными к DCA как в экспериментах in vitro, так и in vivo [39] . Поскольку DCA способствует окислительному фосфорилированию за счет снижения гликолитической активности, сочетание DCA с другими препаратами, усиливающими состояние зависимости от глюкозы, может быть многообещающей стратегией. Такой подход был опробован при раке головы и шеи, при котором введение пропранолола, неселективного бета-блокатора, способного влиять на митохондриальный метаболизм опухолевых клеток, вызывало гликолитическую зависимость и энергетический стресс, делая клетки более уязвимыми для лечения DCA [40] . Аналогичные результаты были получены в клетках меланомы, в которых введение ингибиторов рецептора ретиноевой кислоты β (RARβ) вызывало сенсибилизацию к DCA [41] . Положительный эффект совместного введения DCA с метформином, гипогликемическим препаратом, широко используемым для лечения диабета, был продемонстрирован в доклинической модели глиомы [42] , а также в низкометастатическом варианте карциномы легких Льюис (LLC) [43] . Цзян и его коллеги исследовали эффекты фенформина, аналога метформина, и DCA в глиобластоме, продемонстрировав, что одновременное ингибирование комплекса I и PDK фенформином и DCA, соответственно, снижало самообновление и жизнеспособность стволовых клеток глиомы (GSC), что предполагает их возможное использование для воздействия на фракцию стволовых клеток рака [44] .
| Лекарство | Основная функция | Опухолевая сущность | Модельная система | Исход | Ссылки |
| Салиномицин | Антибиотик | Колоректальный рак | Линии клеток DLD-1 и HCT116 | Ингибирование белков, связанных с множественной лекарственной устойчивостью | [37] |
| Аргиназа | Метаболизм аргинина | Рак молочной железы | Модель MDA-MB231 и MCF-7/ксенотрансплантат | Антипролиферативный эффект за счет активации p53 и остановки клеточного цикла | [38] |
| ингибиторы ЦОГ2 | Воспаление | Рак шейки матки | Линии клеток HeLa и SiHa/модель ксенотрансплантата | Подавление роста раковых клеток | [39] |
| Пропранолол | Бета-блокатор | Рак головы и шеи | Клеточные линии mEERL и MLM3/C57Bl/6 м | Повышение глюкозозависимости и усиление эффекта химиолучевой терапии | [40] |
| Ингибиторы RARβ | Метаболизм витамина А | Меланома | Клеточные линии ED-007, ED-027, ED-117 и ED196 | Развитие зависимости от глюкозы и сенсибилизация к DCA | [41] |
| Метформин | Диабет | Глиома, карцинома легких Льюиса | Модель ксенотрансплантата; клетки LLC/R9 | Продление жизни мышей с глиомой; сильная зависимость от глюкозы в микроокружении опухоли | [42, 43] |
| Фенформин | Диабет | Глиобластома | Модель стволовых клеток глиомы/ксенотрансплантата | Торможение самообновления раковых стволовых клеток | [44] |
Таблица 2: Список препаратов, основная функция которых была протестирована в сочетании с DCA на нескольких моделях рака.
Совместное использование DCA и натуральных соединений
Клиническое применение природных соединений представляет собой многообещающий новый подход к лечению ряда заболеваний [45] . Все больше литературы подтверждает обнаружение среди природных соединений биологически активных веществ, выделенных растениями, грибами, бактериями или морскими организмами, которые оказывают благотворное воздействие на здоровье человека [46–48] . Предположение о природных соединениях или их производных, по-видимому, представляет собой обнадеживающий подход к предотвращению возникновения или рецидива рака, и это обычно называется химиопрофилактикой [49] . Более того, природные вещества оказывают благотворное воздействие при терапии рака при совместном введении с другими препаратами, демонстрируя их способность преодолевать лекарственную устойчивость, увеличивать противораковый потенциал и снижать дозы лекарств и токсичность [50, 51] . Интересно, что недавно было предложено совместное введение DCA и природных соединений. В исследовании изучалось комбинированное действие DCA с куркумином, смешанным с эфирным маслом, соединением с полезными свойствами как для профилактики, так и для лечения рака [52] , демонстрирующим противораковый потенциал против HCC [53] . В частности, сочетание обоих соединений синергически снижало выживаемость клеток, способствуя апоптозу клеток и вызывая внутриклеточную генерацию ROS. Бетулин, природное соединение, выделенное из бересты, уже известно своим антипролиферативным и цитотоксическим действием против нескольких линий раковых клеток [54–56] . Исследование противоопухолевой активности производных бетулина in vitro при НМРЛ подтвердило его способность ингибировать in vivo и in vitro рост клеток рака легких, блокируя фазу G2/M клеточного цикла и вызывая активацию каспазы и фрагментацию ДНК. Интересно, что производное бетулина Bi-L-RhamBet было способно нарушать митохондриальную электрон-транспортную цепь (ETC), вызывая выработку ROS. Учитывая свойство DCA увеличивать общее окисление глюкозы в митохондриях через цикл Кребса и ETC, авторы объединили Bi-L-RhamBet с DCA, продемонстрировав его значительную потенцированную цитотоксичность [57] .
DCA и радиосенсибилизация
Радиотерапия представляет собой еще одну стратегию лечения рака и обеспечивает локальный подход путем введения высокоэнергетических лучей [58] . Основным эффектом облучения является индукция ROS с последующим повреждением ДНК, хромосомной нестабильностью и гибелью клеток путем апоптоза [59] . Однако некоторые опухоли демонстрируют или развивают радиорезистентность, которая является причиной неудачи радиотерапии и высокого риска рецидива опухоли или метастазирования [60] . Несколько факторов могут быть ответственны за радиорезистентность [61] . Среди них гипоксия, распространенное состояние микросреды опухоли, характеризующееся низким уровнем кислорода и сниженной генерацией видов ROS, может блокировать эффективность ионизирующего излучения [62] . Поэтому увеличение оксигенации опухоли таким образом, чтобы способствовать значительному количеству ROS [63] или напрямую индуцировать выработку ROS, может представлять собой стратегию повышения радиосенсибилизации [64 , 65] . В этой ситуации введение DCA, которое, как известно, индуцирует выработку ROS [11, 66] , может представлять собой стратегию преодоления радиорезистентности опухоли. Более того, известно, что метаболические изменения, характерные для развития рака, влияют на радиочувствительность [67, 68] . Следовательно, нацеливание на промежуточные продукты метаболизма рака может представлять собой стратегию улучшения селективного ответа рака на облучение [69] . Эффективность DCA для повышения радиочувствительности уже была продемонстрирована как на клетках глиобластомы [70] , так и на плоскоклеточной карциноме пищевода [71] . Совсем недавно было продемонстрировано, что DCA повышает радиочувствительность в клеточной модели медуллобластомы, смертельной опухоли мозга у детей, вызывая изменения метаболизма ROS и функции митохондрий и подавляя способность к восстановлению ДНК [72] . Поскольку роль иммунотерапии в восстановлении иммунной защиты против прогрессирования опухоли и метастазирования привлекает большое внимание в последние годы [73] , Гупта и Двараканат представили современное состояние возможных эффектов гликолитических ингибиторов, включая DCA, на радиосенсибилизацию опухоли, сосредоточив свое внимание на взаимодействии между метаболическими модификаторами и иммунной модуляцией в процессах радиосенсибилизации [74] . Интересно, что они сообщили о способности DCA способствовать иммунной стимуляции посредством ингибирования накопления лактата, что еще больше поддерживает его использование в качестве адъюванта радиотерапии.
DCA и новые лекарственные формы
Растет интерес к разработке новых лекарственных форм для улучшения доставки лекарств, повышения эффективности и снижения доз и, следовательно, нежелательных эффектов. В этой ситуации системы доставки лекарств (СДЛ) представляют собой новый рубеж в современной медицине [75] . СДЛ предлагают возможность создания гибрида металлоорганических каркасов (МОФ), сочетающего биосовместимость органической системы с высокими нагрузками неорганической фракции [76] . Несколько линий доказательств предполагают эффективную функционализацию наночастиц с помощью ДКА. Лазаро и коллеги [77] исследовали различные протоколы для функционализации ДКА наночастиц терефталата циркония (Zr) (UiO-66). Они продемонстрировали цитотоксичность и селективность тех же СДЛ против различных линий раковых клеток. Более того, они исключили возможную реакцию иммунной системы на ДКА-МОФ in vitro. Та же группа позже показала возможность загрузки Zr MOF вторым противораковым препаратом, таким как 5-фторурацил (5-FU), чтобы воспроизвести синергический эффект двух препаратов [78] . MOF на основе циркония, загруженный DCA, также был предназначен в качестве привлекательной альтернативы UiO-66, показывая селективную цитотоксичность in vitro по отношению к нескольким линиям раковых клеток и хорошую переносимость иммунной системой нескольких видов [79] . Недавно Štarha et al. [80] впервые синтезировали и охарактеризовали полусэндвич-комплексы, содержащие рутений или осмий и DCA (рисунок 2(a)). Оба комплекса Ru-dca и Os-DCA были проверены на линиях клеток карциномы яичников, продемонстрировав большую цитотоксичность, чем цисплатин в отдельности. Оба комплекса были способны индуцировать высвобождение цитохрома c (Cytc) из митохондрий, косвенный показатель активации апоптосомы, и, по-видимому, были менее токсичными по отношению к здоровым первичным гепатоцитам человека, что указывает на селективность в отношении рака по сравнению с нераковыми клетками. Многообещающие результаты были также получены в клетках рака молочной железы с тройным негативом [81] . Конъюгат рения (I)-DCA продемонстрировал эффективное проникновение в раковые клетки и селективное накопление в митохондриях, вызывая митохондриальную дисфункцию и метаболические нарушения [82] . В последние годы было разработано несколько многоактивных препаратов для современного нацеливания на различные внутриклеточные пути с использованием одной формулы. Безопасная, простая, воспроизводимая наноформула комплекса доксорубицинDCA (рисунок 2(b)) была успешно испытана на модели меланомы у мышей, показав увеличение способности к загрузке препарата, снижение побочных эффектов и усиление терапевтического эффекта [83] . Были синтезированы противоопухолевые пролекарства Pt (IV) двойного действия китеплатина с аксиальными лигандами DCA (рисунок 2(c)), охарактеризованы и протестированы на различных линиях опухолевых клеток и in vivo [84]. Для преодоления резистентности рака были предложены тройные производные Pt (IV) цисплатина в качестве новых мощных противораковых агентов, способных конъюгировать действие цисплатина, ингибиторов циклооксигеназы и DCA (рисунок 2(d)) [85] . Новый комплекс, содержащий DCA, платину и биотин (DPB), был успешно испытан, демонстрируя многогранные противоопухолевые свойства (рисунок 2(e)). Авторы продемонстрировали способность такого пролекарства влиять на энергетический метаболизм, способствовать апоптозу и взаимодействовать с ДНК. Высокая селективность биотина в отношении раковых клеток сводит к минимуму пагубное воздействие на нормальные клетки и улучшает лечебный эффект на опухоли [86] . Характеристики и экспериментальные доказательства основных классов соединений обобщены в таблице 3.
| Класс лекарственной формы | Функции | Тесты in vitro | Тесты in vivo | Экспериментальные доказательства | Ссылки |
| Металло-DCA каркасы (без платины) | Ионы металлов, связанные с органическими лигандами в пористые каркасы | MCF-7/MDA-MB-231 (молочная железа) HeLa/LO2 (шейка матки) A2780 (яичник) A549/NCl-H1229 (легкое) | Модели грудных мышей | Биосовместимость, избирательная цитотоксичность, совместимость с иммунной системой, низкая мутагенность. | [77–82 ] |
| Конъюгат доксорубицина-DCA | Комплексы ДХА и химиотерапевтических препаратов | B16F10 (меланома) | Мышиные модели саркомы и меланомы | Безопасность селективной цитотоксичности. Эффективность противоопухолей in vivo. | [83] |
| Платиновые пролекарства с DCA | Платиновое ядро, связанное с DCA и другими препаратами | MCF-7 (молочная железа) LoVo/HCT-15/HCT116 (толстая кишка) A549 (легкие) BxPC3/PSN-1 (поджелудочная железа) A375 (меланома) BCPAP (щитовидная железа) HeLa (шейка матки) HepG2 (гепатокарцинома) | Мышиные модели карциномы легких | Избирательная цитотоксичность, множественное действие. Увеличение клеточного поглощения. | [84–86 ] |
Таблица 3: Свойства основных классов лекарственных форм DCA, протестированные на линиях раковых клеток и моделях in vivo с соответствующими экспериментальными доказательствами.
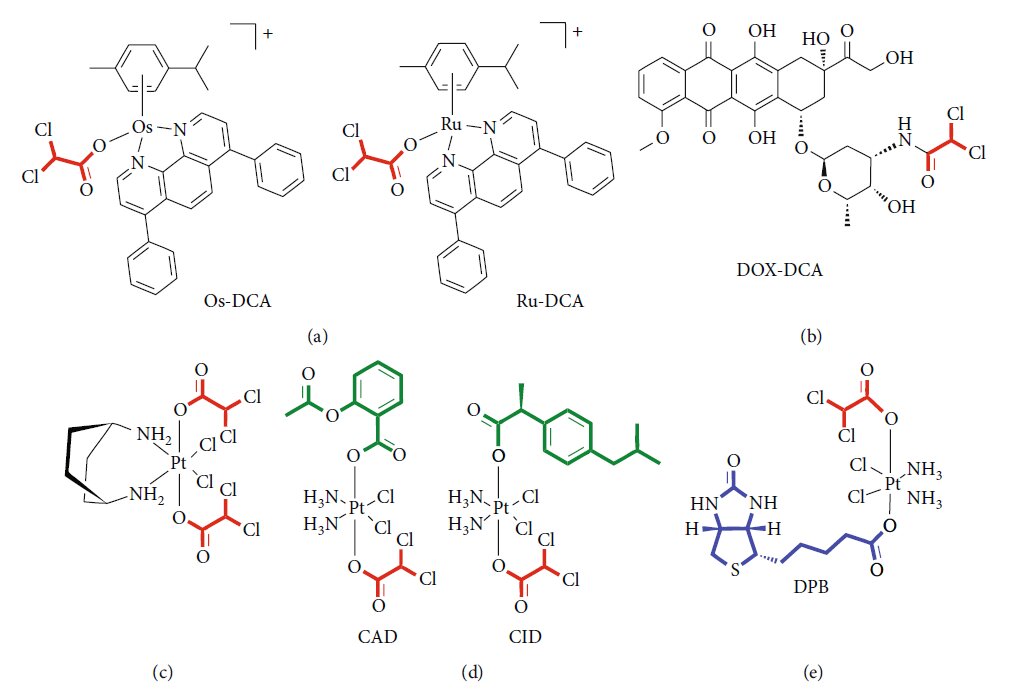 Рисунок 2: Новые лекарственные формы, содержащие DCA. (a) Схематическое изображение комплексов Os-DCA и Ru-DCA [81]. (b) Комплекс доксорубицин (DOX)-DCA [83]. (c) Пролекарства Pt двойного действия китеплатина и DCA [84]. (d) Примеры производных Pt(IV) тройного действия цисплатина, содержащих DCA (красный), производные цисплатина (черный) и ингибиторы COX (зеленый) [85]. (e) Химическая структура DPB, содержащего DCA (красный), биотин (синий) и комплекс платины (Pt) (черный) [86].
Рисунок 2: Новые лекарственные формы, содержащие DCA. (a) Схематическое изображение комплексов Os-DCA и Ru-DCA [81]. (b) Комплекс доксорубицин (DOX)-DCA [83]. (c) Пролекарства Pt двойного действия китеплатина и DCA [84]. (d) Примеры производных Pt(IV) тройного действия цисплатина, содержащих DCA (красный), производные цисплатина (черный) и ингибиторы COX (зеленый) [85]. (e) Химическая структура DPB, содержащего DCA (красный), биотин (синий) и комплекс платины (Pt) (черный) [86].
Другие предлагаемые механизмы действия DCA
Метаболический сдвиг от гликолиза к окислению глюкозы из-за ингибирования PDK и последующей активации PDH является наиболее известным и общепринятым молекулярным эффектом введения DCA. Последующие биохимические изменения, включая увеличение ROS и изменение потенциала митохондриальной мембраны, могут быть ответственны за остановку пролиферации и гибель раковых клеток, тем самым объясняя полезный потенциал DCA в лечении рака [9] . Однако молекулярные промежуточные продукты, активируемые после введения DCA, до сих пор неизвестны. Вполне возможно, что такая малая молекула может напрямую или косвенно влиять на другие клеточные и молекулярные мишени (рисунок 3), демонстрируя другие механизмы действия, чтобы объяснить ее эффективность также в клеточных моделях, где она не производит ожидаемого метаболического сдвига [12] . Протеомный подход, примененный к клеткам рака легких, продемонстрировал способность DCA увеличивать концентрацию каждого промежуточного продукта TCA, при этом он не влиял на поглощение глюкозы или гликолитический процесс от глюкозы до пирувата [87] . В попытке пролить свет на механизм действия DCA, Дюбуа и коллеги использовали подход, основанный на метаболомике, на нескольких линиях клеток рака яичников, обработанных DCA, и обнаружили общее заметное истощение внутриклеточного пантотената, предшественника CoA, а также сопутствующее увеличение CoA, что предполагает способность DCA увеличивать биосинтез CoA de novo. Поскольку высокие концентрации CoA оказались токсичными для клеток, этот метаболический эффект может быть ответственен за токсичность раковых клеток, опосредованную DCA [88] . Совсем недавно работа Эль Сайеда и соавторов представила новую основанную на доказательствах гипотезу, предполагающую, что эффективность DCA против рака может быть обусловлена его способностью противодействовать ацетату [89] , который, как известно, является энергетическим субстратом для глиобластомы и метастазов в мозг, способным усиливать синтез ДНК, РНК и белка, а также посттрансляционные модификации, тем самым способствуя пролиферации клеток и прогрессированию рака. Более того, высокие уровни ацетата связаны с устойчивостью к противораковым препаратам [90] . Было показано, что DCA способен обращать вспять метаболические изменения, вызванные ацетатом, восстанавливая физиологические уровни сывороточного лактата и свободных жирных кислот, а также концентрацию калия и фосфора. По мнению авторов, благодаря структурному сходству с ацетатом, DCA может ингибировать метаболические эффекты, вызванные ацетатом, ответственные за рост раковых клеток и химиорезистентность [89] . Другим возможным дополнительным эффектом DCA может быть модуляция pH. Известно, что модуляция уровня pH влияет на процессы пролиферации и апоптоза [91] , а также на чувствительность к химиотерапии [92].Обработка DCA может как увеличивать, так и уменьшать внутриклеточный pH. Вторичным эффектом перенаправления пирувата в митохондрии с помощью DCA будет снижение лактата и последующее увеличение внутриклеточного pH. С другой стороны, DCA способен уменьшать экспрессию монокарбоксилатных транспортеров и V-АТФазы с последующим снижением pH, и это особенно происходит в опухолевых клетках, экспрессирующих большее количество этих переносчиков по сравнению с нормальными аналогами [93] . Учитывая способность вызывать быстрое внутриклеточное закисление опухоли, Albatany et al. [94] предположили о возможном использовании DCA в качестве трекера при визуализации in vivo мышиной модели глиобластомы и поддержали терапевтическое использование DCA, поскольку известно, что внутриклеточное закисление вызывает активацию каспазы и фрагментацию ДНК раковых клеток [95] . Животные модели позволяют идентифицировать возможную дополнительную молекулярную мишень DCA. Эксперименты, проведенные на крысах, подчеркнули способность DCA ингибировать экспрессию почечного котранспортера Na-K-2Cl (NKCC) в почках крыс [96] . Поскольку NKCC является важным биомаркером регуляции внеклеточного и внутриклеточного ионного гомеостаза и участвует в прогрессировании клеточного цикла, он играет важную роль в пролиферации раковых клеток, апоптозе и инвазии. Белкахла и др. [97] исследовали взаимодействие между таргетингом метаболизма и экспрессией транспортеров ABC, ответственных за экспорт лекарств из клеток и последующую множественную лекарственную устойчивость, и обнаружили, что лечение DCA способно снизить экспрессию генов и белков транспортеров ABC в нескольких опухолевых клетках, экспрессирующих дикий тип p53, как in vitro, так и in vivo [98] . Уже была продемонстрирована способность DCA вызывать дифференциацию посредством модуляции взаимодействия PKM2/Oct4 в клетках глиомы [99] . Полученное снижение уровней транскрипции Oct4 было связано с уменьшением фенотипа стволовости и значительным повышением чувствительности к клеточному стрессу. Это наблюдение позволяет предположить потенциальную роль DCA против раковых стволовых клеток (CSC).
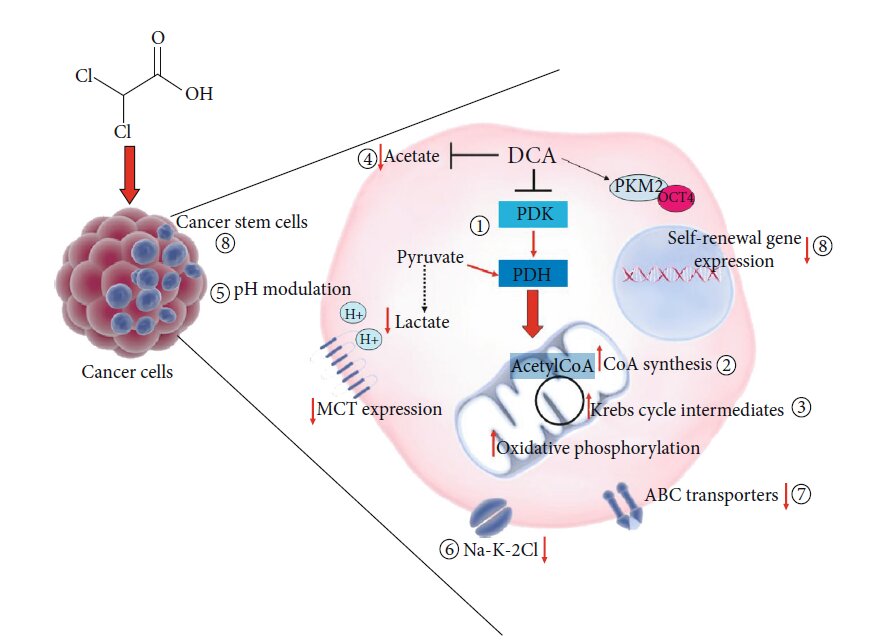 Рисунок 3: Другие предлагаемые механизмы действия DCA. Основной механизм действия DCA заключается в ингибировании пируватдегидрогеназной киназы (PDK), что приводит к активации пируватдегидрогеназы (PDH) и содействует окислительному фосфорилированию (1). DCA также увеличивает концентрацию промежуточных продуктов каждого цикла Кребса (2) [87]. DCA вызывает токсичность клеток посредством синтеза CoA de novo (3) [88]. DCA может противодействовать ацетату (4) [90]. DCA модулирует внутриклеточное закисление (5) [93, 94]. DCA ингибирует котранспортер Na-K-2Cl (6) [96]. DCA подавляет экспрессию генов и белков транспортеров ABC (7) [97]. DCA снижает экспрессию генов, связанных с самообновлением, и влияет на фракцию стволовых клеток рака (8) [99].
Рисунок 3: Другие предлагаемые механизмы действия DCA. Основной механизм действия DCA заключается в ингибировании пируватдегидрогеназной киназы (PDK), что приводит к активации пируватдегидрогеназы (PDH) и содействует окислительному фосфорилированию (1). DCA также увеличивает концентрацию промежуточных продуктов каждого цикла Кребса (2) [87]. DCA вызывает токсичность клеток посредством синтеза CoA de novo (3) [88]. DCA может противодействовать ацетату (4) [90]. DCA модулирует внутриклеточное закисление (5) [93, 94]. DCA ингибирует котранспортер Na-K-2Cl (6) [96]. DCA подавляет экспрессию генов и белков транспортеров ABC (7) [97]. DCA снижает экспрессию генов, связанных с самообновлением, и влияет на фракцию стволовых клеток рака (8) [99].
DCA и раковые стволовые клетки
Растет интерес к таргетированию раковых стволовых клеток (CSC), которые, по-видимому, являются основной причиной рецидива опухоли [100] . CSC обладают способностью к самообновлению с нормальными стволовыми клетками и могут давать начало дифференцирующимся клеткам, ответственным за возникновение опухоли, а также злокачественную прогрессию [101] . Низкая скорость пролиферации и специфический метаболический профиль способствуют тому, что CSC становятся устойчивыми к традиционной химиотерапии [102] . Возникла острая необходимость в разработке новых терапевтических средств, способных влиять на жизнеспособность раковых стволовых клеток [103] с целью полного уничтожения опухолевой массы. Обширный объем литературы фокусирует внимание на метаболическом фенотипе CSC, которые, по-видимому, отличаются от дифференцированных раковых клеток и могут представлять собой терапевтическую мишень [104–108] . В этой ситуации была выдвинута гипотеза о возможной чувствительности фракции CSC к DCA, которая была протестирована на различных моделях рака. Эмбриональные стволовые клетки карциномы представляют собой одну из наиболее подходящих моделей для изучения поддержания и дифференциации CSC, а также идентификации препаратов и молекул, способных модулировать эти процессы [109] . Исследования, проведенные на эмбриональных стволовых клетках (ESC), представляют собой предварительные важные доказательства, подтверждающие возможную эффективность DCA [110] . Интересно, что обработка ESC DCA способствует потере плюрипотентности и сдвигает их в сторону более активного окислительного метаболизма, что сопровождается значительным снижением экспрессии HIF1a и p53 [111] . Вега-Наредо и др. [112] описали важность митохондриального метаболизма в управлении стволовостью и дифференциацией в такой модели. Они охарактеризовали метаболический профиль фракции стволовых клеток и предположили меньшую восприимчивость фенотипа ствола к митохондриально-направленной терапии. Принуждение CSC к окислительному метаболизму путем обработки DCA позволило перейти от стволовости к дифференциации. Несколько отчетов подтверждают существование CSC в глиоме [113, 114] , и эффективность DCA для поражения CSC была широко оценена при таком типе рака, который так трудно лечить обычными методами и который характеризуется низкими показателями выживаемости. Еще в 2010 году Микелакис и коллеги предположили, как in vitro, так и in vivo, способность DCA вызывать апоптоз фракции стволовых клеток рака [26] . Модель глиомы на крысах, повторяющая несколько особенностей человеческой глиобластомы, подтвердила эффективность DCA для потенцирования апоптоза CSC глиомы, характеризующегося значительной сверхстимуляцией гликолитического пути по сравнению с нормальными стволовыми клетками [115]. Кроме того, Цзян и др. исследовали влияние DCA на небольшую популяцию стволовых клеток глиомы (GSC), выделенных из глиобластомы, продемонстрировав снижение свойств самообновления и увеличение процента гибели клеток [44] . Более того, тест in vivo на мышах с ксенотрансплантатами, полученными из GSC, обработанных DCA, показал значительное увеличение общей выживаемости. Лечение DCA также было протестировано на фракции стволовых клеток меланомы, и полученная биоэнергетическая модуляция смогла противодействовать протуморогенному действию ингибитора c-Met [116] . Совсем недавно проведенная работа на гепатоцеллюлярной карциноме человека выявила сверхэкспрессию PDK4 в сферах, происходящих из раковых клеток, с определенным фенотипом, подобным стволовому. Интересно, что лечение DCA смогло снизить жизнеспособность как раковых дифференцированных клеток, так и раковых стволовых клеток и обратить вспять химиорезистентность к традиционной терапии [36] . Наша группа недавно испытала способность DCA снижать экспрессию маркеров стволовых клеток рака CD24/CD44/EPCAM в клеточной линии рака поджелудочной железы, а также нарушать образование и жизнеспособность сфероидов [12] , что дополнительно подтверждает данные, полученные в других моделях рака. Наряду с химиорезистентностью, радиорезистентность также представляет собой ограничение эффективного лечения рака, и CSC, по-видимому, ответственны за такую рефрактерность [117] . Сан и др. продемонстрировали способность DCA повышать радиочувствительность клеток медуллобластомы, влияя на стволоподобные клоны, снижая процент экспрессии CD133-позитивных клеток и уменьшая образование сфер [72] . Более того, в той же клеточной модели они показали измененный механизм репарации ДНК, вызванный DCA, способный объяснить повышенную эффективность радиотерапии.
Выводы
Нацеливание на метаболизм раковых клеток представляет собой новый фармакологический подход к лечению рака. Способность DCA переключать метаболизм с гликолиза на окислительное фосфорилирование увеличила интерес к этому препарату, уже известному своими противораковыми свойствами. Накопленные за последние годы доказательства подтверждают способность DCA преодолевать химио- и радиорезистентность при нескольких типах рака и позволяют выдвинуть гипотезу о дополнительных клеточных мишенях, способных объяснить его способность убивать раковые клетки. Необходимо разработать дальнейшие клинические исследования, которые в настоящее время ограничены пациентами с плохим прогнозом и запущенными рецидивирующими новообразованиями, уже не поддающимися другим традиционным методам лечения. Его потенциальная эффективность против раковых стволовых клеток, а также разработка новых лекарственных форм приближают нас к достижению эффективного клинического применения DCA.
Конфликты интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Данная работа была поддержана Текущими исследовательскими фондами Министерства здравоохранения Италии в IRCCS-CROB, Рионеро-ин-Вультуре, Потенца, Италия.
Амигдалин блокирует in vitro адгезию и инвазию клеток почечно-клеточной карциномы с помощью интегрин-зависимого механизма
Амигдалин блокирует in vitro адгезию и инвазию клеток
почечно-клеточной карциномы с помощью интегрин-зависимого механизма
- Автор:
- Ева Юнгель
- Масуд Афшар
- Ясмина Макаревич
Аннотация
Информация о природном соединении амигдалине, которое используется в качестве противоопухолевого средства, скудна, и поэтому его эффективность остается спорной. В этом исследовании, чтобы определить, оказывает ли амигдалин противоопухолевое действие на клетки почечно-клеточной карциномы (ПКР), было изучено его влияние на метастатическую активность ПКР. Клеточные линии ПКР, Caki-1, KTC-26 и A498, были подвергнуты воздействию амигдалина из абрикосовых косточек, и была исследована адгезия к эндотелию сосудов человека, иммобилизованному коллагену или фибронектину. Было также определено влияние амигдалина на хемотаксическую и инвазивную активность, а также влияние амигдалина на поверхностную и общую клеточную экспрессию α и β интегринов, которые участвуют в метастазировании. Мы отметили, что амигдалин вызвал значительное снижение хемотаксической активности, инвазии и адгезии к эндотелию, коллагену и фибронектину. Используя анализ FACScan, мы отметили, что амигдалин также индуцировал снижение, особенно в интегринах α5 и α6, во всех трех клеточных линиях. Функциональное блокирование α5 привело к значительному снижению адгезии KTC-26 и A498 к коллагену, а также к снижению хемотаксического поведения во всех трех клеточных линиях. Блокирование интегрина α6 значительно снизило хемотаксическую активность во всех трех клеточных линиях. Таким образом, мы предполагаем, что воздействие амигдалина на клетки почечно-клеточного рака ингибирует метастатическое распространение и связано с подавлением интегринов α5 и α6. Поэтому мы предполагаем, что амигдалин оказывает противоопухолевую активность in vitro, и это может быть связано с регуляцией интегрина.
Введение
Почечно-клеточная карцинома (ПКР) является наиболее распространенной опухолью почки. Примерно у трети пациентов есть метастазы на момент постановки диагноза, и до 30% пациентов развивают метастазы во время терапии. После метастазирования прогноз для пациентов неутешительный. Лучшее понимание молекулярных механизмов действия, лежащих в основе развития и прогрессирования ПКР, способствовало разработке таргетной терапии, тем самым улучшая прогноз для пациентов на поздних стадиях этого заболевания. Однако, несмотря на эти терапевтические достижения, прогноз для пациентов с ПКР остается неблагоприятным, 5-летняя выживаемость составляет от 5 до 12%. Неудовлетворенность традиционной терапией и желание уменьшить побочные эффекты привели многих пациентов к комплементарной и альтернативной медицине (КАМ). До 80% онкологических больных в Соединенных Штатах и более 50% онкологических больных в Европе используют КАМ наряду с традиционной терапией или вместо нее.
Информация об эффективности природных соединений скудна, и некоторые из этих соединений, такие как цианогенный дигликозид амигдалин (D-манделонитрил-β-гентиобиозид), остаются спорными. Амигдалин получают из плодовых косточек семейства розоцветных, которое включает Prunus persica (персик), Prunus armeniaca (абрикос) и Prunus amygdalus var. amara (горький миндаль). Амигдалин, в основном в Соединенных Штатах, назначают онкологическим больным с 1920-х годов. В 1950-х годах была синтезирована и запатентована внутривенная, химически иная форма амигдалина как лаэтрил. Хотя лаэтрил отличается от амигдалина, эти термины часто используются взаимозаменяемо, что затрудняет интерпретацию данных. К 1978 году около 70 000 онкологических больных в США прошли лечение амигдалином. Однако исследования амигдалина, основанные на фактических данных, остаются ограниченными. Клиническое исследование, спонсируемое Национальным институтом рака более 30 лет назад, не выявило никаких признаков регрессии опухоли ( 1 ), тогда как ретроспективный анализ 67 пациентов с опухолями, получавших амигдалин, сообщил о двух полных и четырех частичных ответах ( 2 ). Амбивалентность также отражена в отчетах о случаях: амигдалин был неэффективен в пяти случаях и эффективен в четырех. Насколько нам известно, рандомизированные клинические испытания и последующие исследования не проводились. Сторонники считают амигдалин эффективным натуральным вариантом лечения рака, тогда как противники предупреждают о токсичности из-за метаболизма цианистого водорода.
Метастазы являются основной причиной смертности, связанной с ПКР. Трансэндотелиальная миграция и подвижное распространение являются критическими этапами в распространении и прогрессировании опухоли ( 3 ), а распространение раковых клеток в отдаленные органы представляет собой основную клиническую проблему при лечении рака. В настоящем исследовании изучалось противоопухолевое действие амигдалина на адгезию и миграционные свойства клеток ПКР. Поскольку интегрины активируют ряд внутриклеточных сигнальных путей, участвующих в пролиферации, дифференцировке и подвижности клеток, был определен паттерн экспрессии рецепторов адгезии интегрина α и β между обработанными амигдалином клетками и необработанными контрольными клетками. Интегрины важны как для здоровья, так и для болезни ( 4 ) и играют ключевую роль в канцерогенезе и прогрессировании рака ( 4 ).
Настоящее исследование основано на предыдущем исследовании, посвященном влиянию амигдалина на метастатические свойства трех линий клеток рака мочевого пузыря ( 5 ). Поскольку были обнаружены некоторые различия в действии амигдалина на метастатические свойства различных линий клеток рака мочевого пузыря, возник вопрос о том, ограничиваются ли различные эффекты амигдалина определенными опухолевыми образованиями или возникают в других. Таким образом, были выбраны три линии клеток RCC, поскольку опухоли RCC являются наиболее агрессивной урологической опухолью.
Материалы и методы
Культура клеток
Клетки карциномы почки, Caki-1, KTC-26 и A498, были приобретены у LGC Promochem GmbH (Wesel, Германия). Клетки выращивали и субкультивировали в среде RPMI-1640 (Seromed, Берлин, Германия) с добавлением 10% сыворотки плода теленка (FCS), 20 мМ буфера HEPES, 100 МЕ/мл пенициллина и 100 мкг /мл стрептомицина при 37°C в увлажненном инкубаторе с 5% CO2 . Субкультуры из пассажей 5–24 были отобраны для экспериментального использования. Эндотелиальные клетки пупочной вены человека (HUVEC) были выделены из пупочных вен человека и собраны путем ферментативной обработки диспазой (1 МЕ/мл; Gibco-Invitrogen, Карлсбад, Калифорния, США). HUVEC выращивали в среде 199 (M199; Biozol, Мюнхен, Германия), дополненной 10% FCS, 10% объединенной человеческой сыворотки, 20 мкг /мл фактора роста эндотелиальных клеток (Boehringer, Мангейм, Германия), 0,1% гепарина, 100 нг/мл гентамицина и 20 мМ буфера HEPES (pH 7,4). Субкультуры из пассажей 1–5 были отобраны для экспериментального использования. Институциональный этический комитет больницы университета Гете, Франкфурт, Германия, отказался от необходимости получения согласия, поскольку HUVEC использовались анонимно для анализов in vitro и не имели связи с данными пациентов.
Лечение амигдалиномы
Амигдалин из абрикосовых косточек (Sigma-Aldrich, Тауфкирхен, Германия) был свежерастворен в среде для культивирования клеток, а затем добавлен к опухолевым клеткам в концентрации 10 мг/мл [ранее оцененной как оптимальная концентрация ( 6 )] либо на 24 часа, либо на 2 недели (лечение применялось три раза в неделю) для оценки острого и хронического лечения. Контрольные группы оставались необработанными. Во всех экспериментах сравнивались обработанные и необработанные культуры опухолевых клеток. Для изучения токсического действия амигдалина жизнеспособность клеток определялась трипановым синим (Gibco-Invitrogen).
Адгезия опухолевых клеток
Для анализа адгезии опухолевых клеток HUVEC переносили в 6-луночные мультипланшеты (Sarstedt, Nümbrecht, Германия) в полной среде HUVEC. Когда они достигали слияния, клетки Caki-1, KTC-26 и A498 отсоединяли от культуральных колб обработкой аккутазой (PAA Laboratories, Cölbe, Германия), а затем добавляли 0,5×10 6 клеток и оставляли на монослое HUVEC на 1, 2 или 4 часа. Затем неприкрепившиеся опухолевые клетки смывали с помощью подогретого (37°C) PBS (Ca 2+ и Mg 2+ ). Оставшиеся клетки фиксировали 1% глутаральдегидом. Подсчет адгезивных опухолевых клеток производился в пяти различных полях определенного размера (5×0,25 мм2 ) с использованием фазово-контрастного микроскопа (ID03, 471202-9903; Carl Zeiss Microscopy GmbH, Геттинген, Германия), после чего рассчитывалась средняя скорость клеточной адгезии.
Присоединение к иммобилизованным белкам внеклеточного матрикса
24-луночные планшеты покрывали коллагеном G (извлеченным из телячьей кожи, состоящим из 90% коллагена типа I и 10% коллагена типа III, и разведенным до 400 мкг /мл в PBS; Biochrom, Берлин, Германия) или фибронектином (извлеченным из мышей и разведенным до 100 мкг /мл в PBS; Becton-Dickinson, Гейдельберг, Германия) на ночь. Пластиковые чашки служили фоновым контролем. Планшеты промывали 1% бычьим сывороточным альбумином (БСА) в PBS для блокирования неспецифической клеточной адгезии. Затем в каждую лунку добавляли опухолевые клетки (0,1×10 6 ) и оставляли на 30 минут для инкубации. Затем не прилипшие опухолевые клетки смывали, оставшиеся прилипшие клетки фиксировали 2% глутаральдегидом и подсчитывали микроскопически. Средний показатель клеточной адгезии, определяемый соотношением адгезивных клеток, хорошо покрытых слоем, и адгезивных клеток, фон, был рассчитан по пяти различным полям наблюдения.
Хемотаксическая активность
Сывороточно-индуцированное хемотаксическое движение исследовали с использованием 6-луночных камер Transwell (Greiner, Frickenhausen, Германия) с порами 8 мкм . Клетки (0,5×10 6 клеток Caki-1, KTC-26 или A498/мл) помещали в верхнюю камеру в бессывороточной среде, либо без амигдалина (контроль), либо содержащей амигдалин. Нижняя камера содержала 10% сыворотки. После ночной инкубации верхнюю поверхность мембраны transwell осторожно протирали ватным тампоном, чтобы удалить клетки, которые не мигрировали. Клетки, перемещающиеся на нижнюю поверхность мембраны, окрашивали гематоксилином и подсчитывали микроскопически. Средняя скорость миграции рассчитывалась из пяти различных полей наблюдения.
Вторжение
Вторжение исследовали с помощью хемотаксического движения, вызванного сывороткой, через мембрану (Greiner) с порами 8 мкм , предварительно покрытую коллагеном G (извлеченным из телячьей кожи, состоящим из 90% коллагена типа I и 10% коллагена типа III; разбавленным до 400 мкг /мл в PBS; Biochrom) и HUVEC, выращенными до слияния. Клетки Caki-1, KTC-26 или A498 (0,5×10 6 /мл) помещали в верхнюю камеру в бессывороточной среде, либо без амигдалина (контроль), либо содержащей амигдалин. Нижняя камера содержала 10% сыворотки. После инкубации в течение ночи верхнюю поверхность мембраны transwell осторожно протирали ватным тампоном, чтобы удалить клетки, которые не мигрировали. Клетки, которые переместились на нижнюю поверхность мембраны, окрашивали гематоксилином и подсчитывали микроскопически. Средний показатель миграции рассчитывался в пяти различных полях наблюдения.
Экспрессия поверхности интегрина
Опухолевые клетки промывали в блокирующем растворе (PBS, 0,5% BSA), а затем инкубировали в течение 60 мин при 4°C с конъюгированными с фикоэритрином (PE) моноклональными антителами, направленными против следующих подтипов интегринов: анти-α1 (мышиный IgG1; клон SR84; #559596), анти-α2 (мышиный IgG2a; клон 12F1-H6; #555669), анти-α3 (мышиный IgG1; клон C3II.1; #556025), анти-α4 (мышиный IgG1; клон 9F10; #555503), анти-α5 (мышиный IgG1; клон IIA1; #555617), анти-α6 (мышиный IgG2a; клон GoH3; #555736), анти-β1 (мышиный IgG1; клон MAR4; #555443), анти-β3 (мышиный IgG1; клон VI-PL2; #555754) или анти-β4 (крысиный IgG2b; клон 439-9B; #555720) (все от BD Pharmingen, Гейдельберг, Германия). Экспрессия интегрина опухолевых клеток затем измерялась с помощью FACScan (BD Biosciences, Гейдельберг; анализ гистограммы канала FL-2H (log); 1×10 4 клеток/сканирование) и выражалась как средняя относительная интенсивность флуоресценции (RFI). В качестве изотипических контролей использовали мышиный IgG1-PE (MOPC-21; #555749), IgG2a-PE (G155-178; #555574) и крысиный IgG2b-PE (R35-38; #555848; все от BD Biosciences).
вестерн-блоттинг
Для исследования содержания интегрина лизаты опухолевых клеток наносили на 7–12% полиакриламидный гель (в зависимости от размера белка) и подвергали электрофорезу в течение 90 мин при 100 В. Затем белок переносили на нитроцеллюлозные мембраны. После блокирования обезжиренным сухим молоком в течение 1 часа мембраны инкубировали в течение ночи со следующими антителами: интегрин α1 (кроличий, поликлональный, 1:1000; #AB1934; Chemicon/Millipore GmbH, Швальбах, Германия), интегрин α2 (мышиный IgG1, 1:250, клон 2; #611017; BD Biosciences), интегрин α3 (кроличий, поликлональный, 1:1000; #AB1920; Chemicon/Millipore GmbH), интегрин α4 (мышиный, 1:200, клон: C-20; #sc-6589; Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния, США)], интегрин α5 (мышиный IgG2a, 1:5000, клон 1; #610634; BD Biosciences), интегрин α6 (кролик, 1:200, клон H-87; #sc-10730; Santa Cruz Biotechnology, Inc.) и интегрин β1 (мышиный IgG1, 1:2500, клон 18; #610468), интегрин β3 (мышиный IgG1, 1:2500, клон 1; #611141) и интегрин β4 (мышиный IgG1, 1:250, клон 7; #611233) (все от BD Biosciences). Конъюгированные с HRP козьи антимышиные IgG и конъюгированные с HRP козьи антикроличьи IgG (оба 1:5000; Upstate Biotechnology, Лейк-Плэсид, штат Нью-Йорк, США) служили в качестве вторичных антител. Кроме того, сигнализация, связанная с интегрином, была исследована с помощью антител к антиинтегрин-связанной киназе (ILK) (клон 3, разведение 1:1000; № 611803), антифокальной адгезионной киназе (FAK) (клон 77, разведение 1:1000; № 610088) и анти-p-специфической FAK (pY397; клон 18, разведение 1:1000; № 611807) (все от BD Biosciences). Конъюгированные с HRP козьи антимышиные IgG (разведение 1:5000; Upstate Biotechnology) служили в качестве вторичных антител. Мембраны были кратковременно инкубированы с реагентом для обнаружения ECL (ECL™; Amersham, GE Healthcare, Мюнхен, Германия) для визуализации белков, а затем проанализированы с помощью системы Fusion FX7 (Peqlab, Эрланген, Германия). β-актин (1:1000; Sigma-Aldrich) служил в качестве внутреннего контроля.
Для анализа плотности пикселей белковых полос использовалось программное обеспечение Gimp 2.8. Было рассчитано соотношение интенсивности белка/интенсивности β-актина, выраженное в процентах по отношению к контрольным значениям, принятым за 100%.
Блокировка экспериментов
Чтобы определить, влияют ли интегрины α5 и α6 на метастатическое распространение независимо от амигдалина в клеточных линиях Caki-1, KTC-26 и A498, клетки инкубировали в течение 60 мин с 10 мкг /мл мышиных моноклональных антител против интегрина α5 (клон P1D6) или крысиных моноклональных антител против интегрина α6 (клон NKI-GoH3) (оба от Millipore). Контрольные образцы инкубировали только с клеточной культуральной средой. Затем адгезию опухолевых клеток к иммобилизованному коллагену, а также хемотаксис анализировали, как описано выше.
Статистический анализ
В настоящем исследовании все эксперименты проводились 3–6 раз. Статистическая значимость определялась с помощью U-критерия Вилкоксона, Манна-Уитни. Значение p < 0,05 считалось указывающим на статистически значимое различие.
Результаты
Амигдалин блокирует взаимодействие между эндотелием опухолевых клеток и матриксом опухолевых клеток
После 24 часов обработки амигдалином адгезия опухолевых клеток A498 к HUVEC значительно снизилась, но адгезия клеток Caki-1 и KTC-26 не снизилась (по сравнению с необработанными контролями, принятыми за 100%) ( рис. 1 ). Увеличение времени воздействия амигдалина до 2 недель значительно снизило адгезию к HUVEC во всех трех линиях опухолевых клеток ( рис. 1 ).
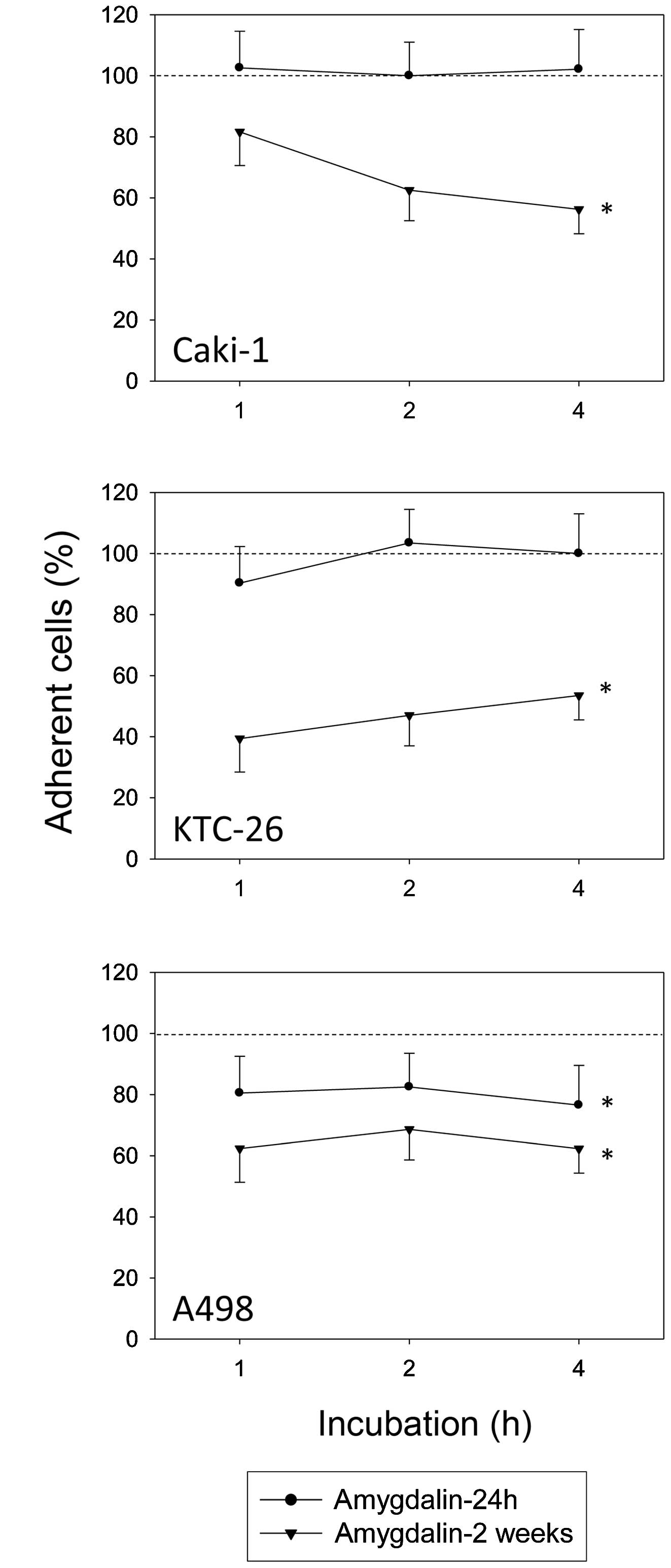 |
Рисунок 1Адгезия Caki-1, KTC-26 и A498 к эндотелию (эндотелиальные клетки пуповины человека; HUVEC). Опухолевые клетки обрабатывали 10 мг/мл амигдалина в течение 24 ч или 2 недель. Контрольные образцы оставались необработанными. Опухолевые клетки (0,5×106 клеток/лунку) добавляли и оставляли на монослое HUVEC в течение 1, 2 или 4 ч. Оценивалось среднее количество адгезированных опухолевых клеток из пяти полей, а также рассчитывался процент обработанных клеток почечно-клеточной карциномы (RCC) по сравнению с необработанными контрольными клетками (принято за 100%, пунктирная линия). *Значительное различие с контрольными образцами. Полоски указывают среднее значение ± стандартное отклонение (SD). n=5 экспериментов, p≤0,05. |
Амигдалин вызвал значительное снижение связывающей способности всех трех линий клеток RCC с иммобилизованным коллагеном и фибронектином по сравнению с контрольной группой ( рис. 2 ). Прикрепление всех трех линий клеток к матричным белкам было снижено через 24 часа, а также через 2 недели. В клеточной линии KTC-26 кратковременное применение амигдалина (24 часа) вызвало большее снижение адгезии, чем долгосрочное применение амигдалина (2 недели).
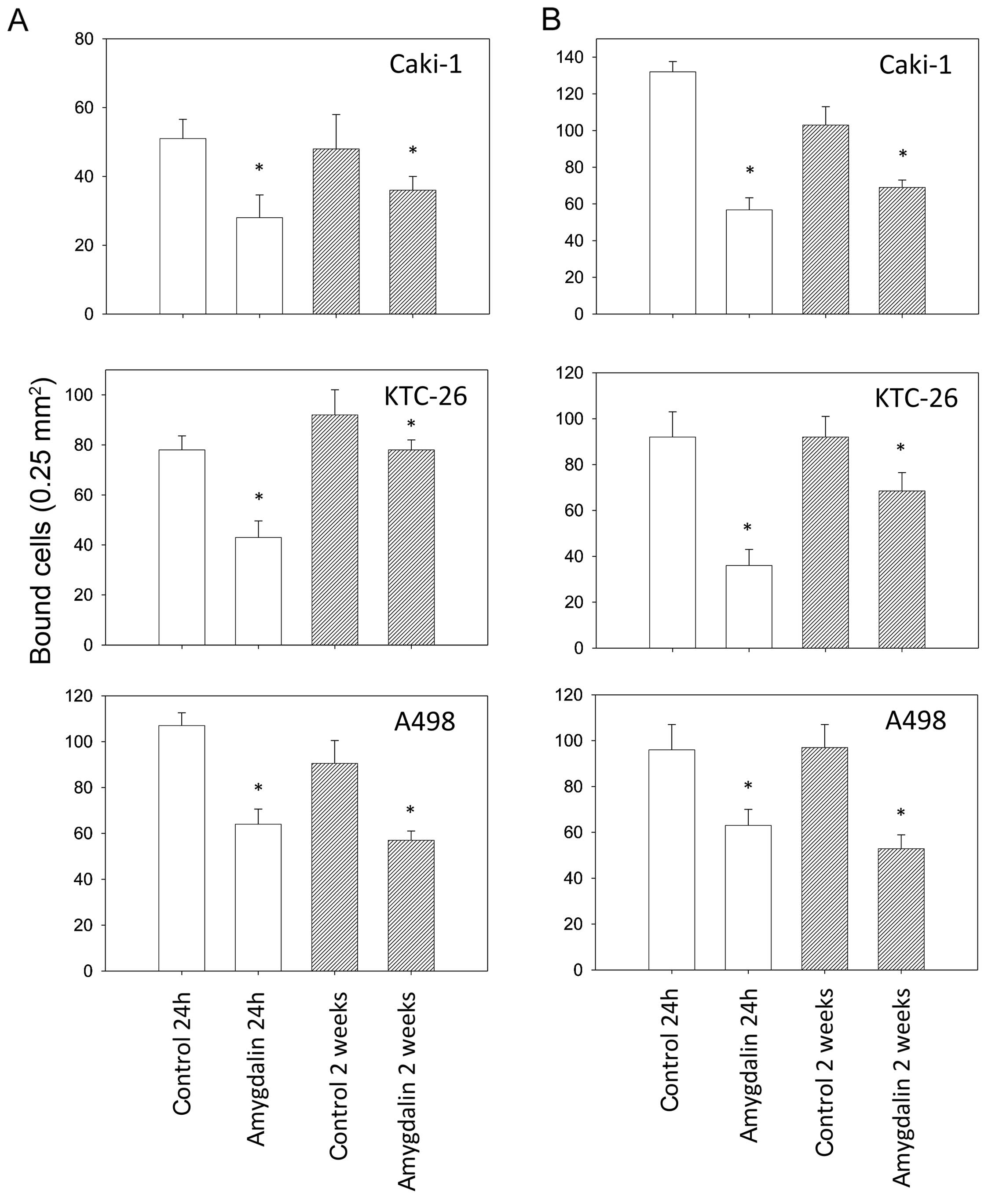 |
Рисунок 2(A) Адгезия Caki-1, KTC-26 и A498 к иммобилизованному коллагену (слева) и (B) фибронектину (справа). Опухолевые клетки обрабатывали 10 мг/мл амигдалином в течение 24 ч или 2 недель. Необработанные клетки почечно-клеточной карциномы (ПКР) служили в качестве контроля. Клетки (0,1×106 клеток/лунка) добавляли к иммобилизованному коллагену или фибронектину. Среднее количество адгезированных опухолевых клеток из пяти полей рассчитывали через 30 мин. *Значительное различие с контролем. Полоски указывают среднее значение ± стандартное отклонение (SD). n=6 экспериментов, p≤0,05. |
Амигдалин изменяет подвижность опухолевых клеток почечно-клеточного рака
Хемотаксическая активность клеток Caki-1, KTC-26 и A498 значительно снизилась после 24 ч и 2 недель применения амигдалина по сравнению с необработанными контрольными клетками ( рис. 3A ). Инвазия опухолевых клеток через покрытые коллагеном мембраны transwell также значительно снизилась в клетках Caki-1 и A498 после 24 ч и 2 недель применения амигдалина ( рис. 3B ). Однако 2 недели применения амигдалина не снизили инвазивную способность клеток KTC-26.
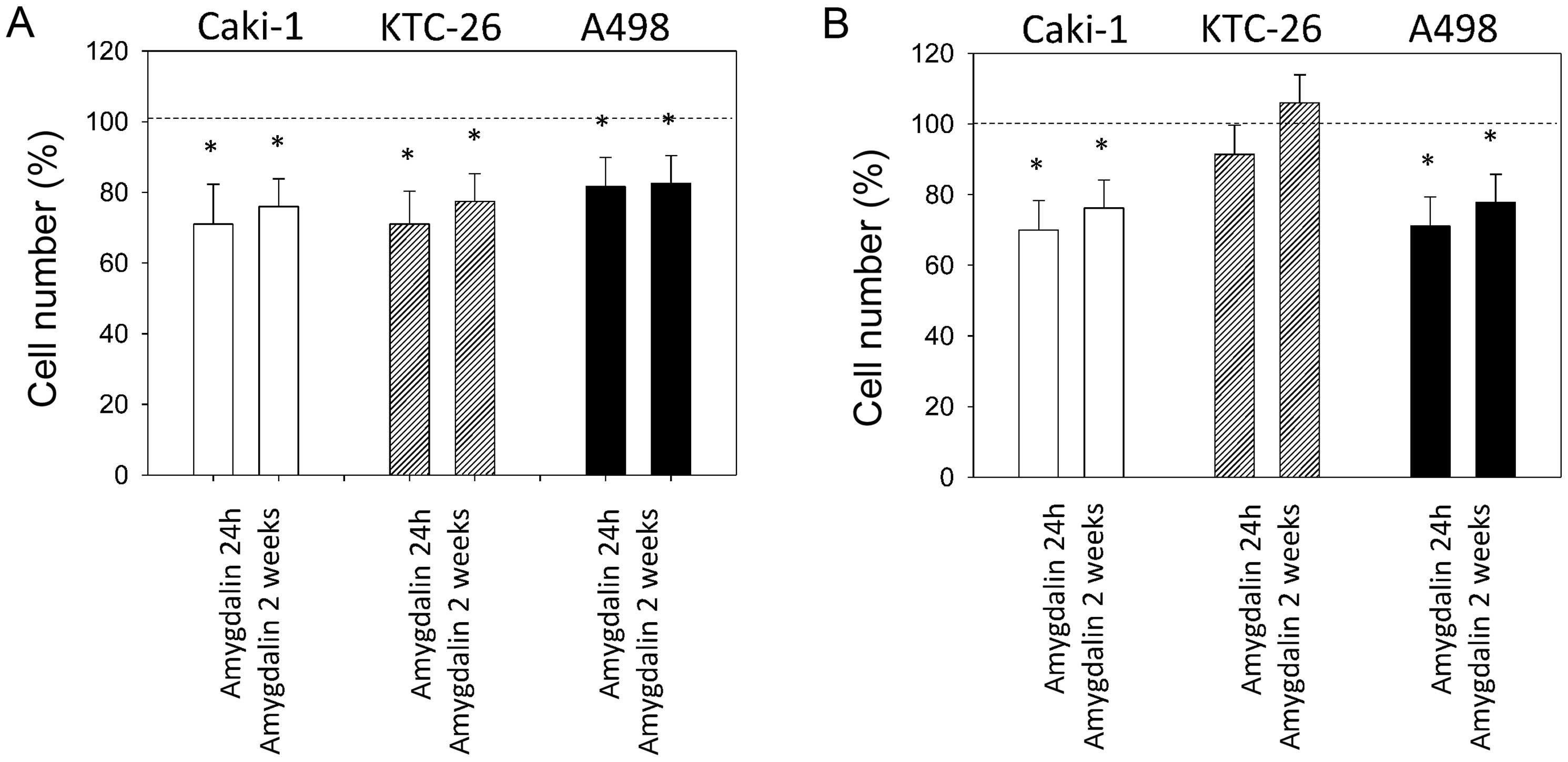 |
Рисунок 3Влияние амигдалина на клетки почечно-клеточной карциномы (ПКР): хемотаксис (A) и инвазия (B). Клетки ПКР, обработанные амигдалином в течение 24 ч или 2 недель, высевали в верхнюю камеру с хемоаттрактантом в лунке ниже. Подсчитывали клетки, мигрирующие через мембрану через 20 ч. Контрольные клетки не получали амигдалин и были установлены на 100% (пунктирная линия). *Значительное различие с контрольными клетками. Полоски указывают среднее значение ± стандартное отклонение (SD). n=5 экспериментов, p≤0,05. |
Амигдалин модулирует поверхностную экспрессию интегрина α и β
Клетки Caki-1, KTC-26 и A498 характеризовались различными базальными поверхностными паттернами экспрессии интегринов α и β ( рис. 4A ). Caki-1 заметно экспрессировал α3 и β1, умеренно экспрессировал α5 и β3, тогда как α1, α2, α4, α6 и β4 были лишь незначительно обнаружены. KTC-26 сильно экспрессировал α3 и β1. Члены подтипа α1, α2, α5, α6, β3 и β4 были умеренно экспрессированы, а α4 не был обнаружен. Профиль экспрессии интегринов A498 был похож на профиль KTC-26, за исключением α4, который был обнаружен для A498. Мы также отметили, что β4 присутствовал в клетках KTC-26, но не в клетках A498.
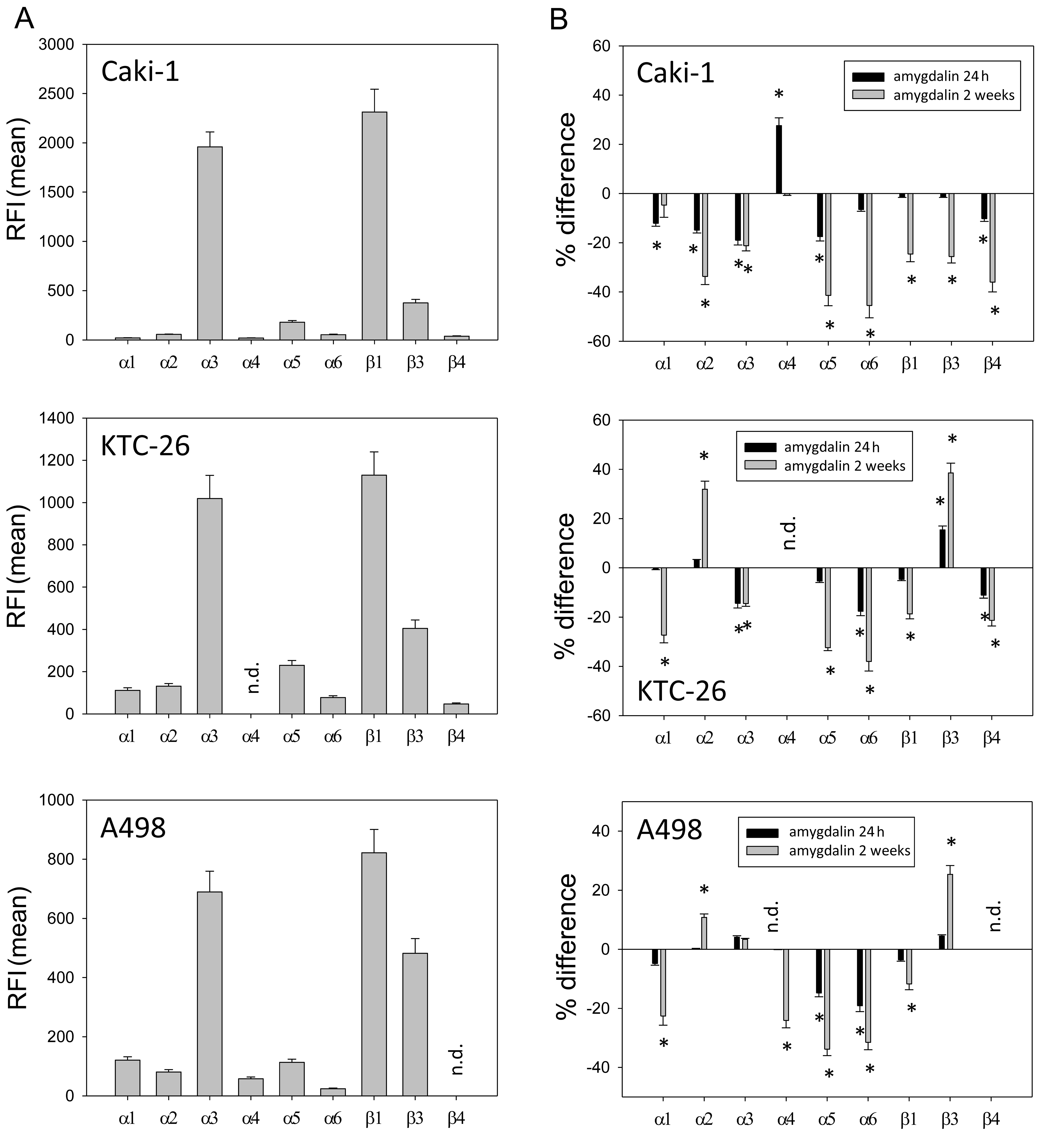 |
Рисунок 4(A) Базальная поверхностная экспрессия подтипов интегрина почечно-клеточной карциномы (RCC) и (B) разница (%) с необработанным контролем через 24 часа или 2 недели воздействия амигдалина. RFI, относительная интенсивность флуоресценции. nd, не обнаруживается. *Значительная разница с контролем. Полоски указывают среднее значение ± стандартное отклонение (SD), p≤0,05. |
Применение амигдалина в течение двадцати четырех часов и в течение двух недель изменило профиль поверхности интегрина, который является специфическим для типа клеток ( рис. 4B ). Мы отметили, что α5 и α6 были значительно подавлены во всех клеточных линиях после двух недель воздействия амигдалина. β1, который был сильно выражен во всех трех клеточных линиях, также был значительно снижен после двух недель применения амигдалина. Высокая базальная экспрессия рецептора α3 была снижена в Caki-1 и KTC-26, но не в A498, под действием амигдалина. Различия также были отмечены в отношении α2 и β3, оба из которых были снижены в клетках Caki-1, но повышены в клетках KTC-26 и A498 через две недели. Сниженные уровни экспрессии β4 были обнаружены в клетках Caki-1 и KTC-26 после воздействия амигдалина.
Амигдалин влияет на общее содержание клеточных интегринов
Оценка содержания белка интегрина после 24 ч воздействия амигдалина выявила значительную положительную регуляцию α2 и отрицательную регуляцию α3 и p-FAK ( рис. 5 ). β1 был значительно повышен в Caki-1 и KTC-26, тогда как α6 был значительно снижен в Caki-1 и A498, а общее содержание α5 было снижено в клетках A498 через 24 ч. В клетках Caki-1 α4 и β4 увеличились, а β3 уменьшился.
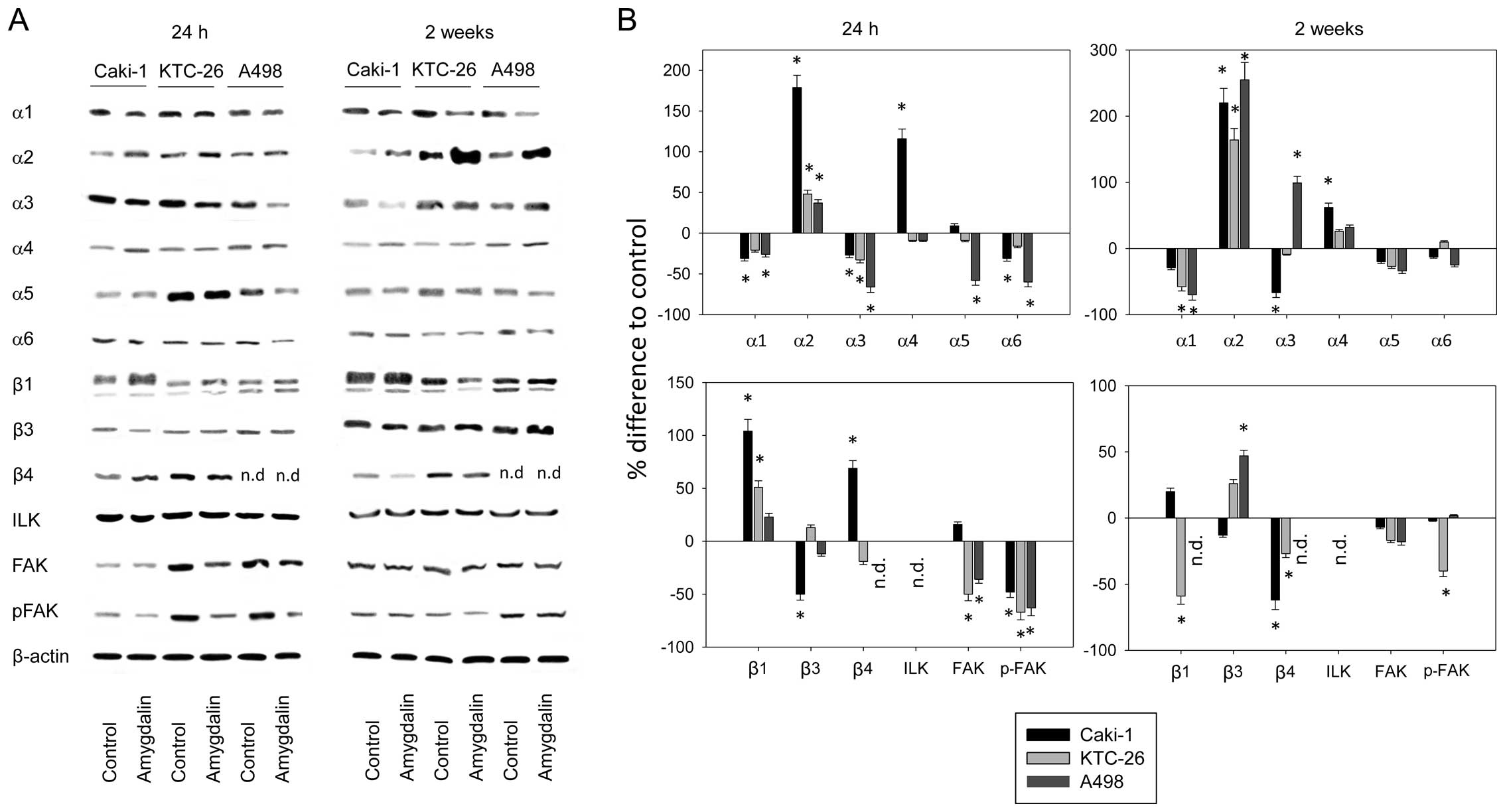 |
Рисунок 5(A) Вестерн-блот-анализ общего содержания интегрина в клетках Caki-1, KTC-26 и A498, подвергнутых воздействию амигдалина в течение 24 ч или 2 недель, и необработанных контролях. В качестве внутреннего контроля использовался β-актин. (B) Анализ плотности пикселей белковых полос вестерн-блоттинга. Соотношение интенсивности белка/интенсивности β-актина было рассчитано и выражено в процентах по отношению к контролям, установленным на 100% (0) после того, как клетки подвергались воздействию амигдалина в течение 24 ч или 2 недель. Показан один представитель из трех отдельных экспериментов. nd, не обнаружено. *Значительное различие с контролями, p≤0,05. |
После 2 недель воздействия амигдалина интегрин α2 значительно увеличился, даже больше, чем после воздействия в течение 24 часов. В клетках A498 α3 и β3 увеличились после 2 недель воздействия амигдалина. Снижение β1 и p-FAK произошло в клетках KTC-26, а β4 был подавлен как в Caki-1, так и в KTC-26 после 2 недель воздействия амигдалина ( рис. 5 ).
Блокировка экспериментов
Профили экспрессии интегрина всех трех линий клеток были изменены амигдалином. Поскольку поверхностный интегрин α5 и интегрин α6 были сильно снижены во всех трех линиях клеток после применения амигдалина, эти интегрины были выбраны для исследований функциональной блокировки, чтобы выяснить, коррелируют ли эти снижения с изменениями адгезии и миграции опухолевых клеток. Блокирование α5 привело к значительному ингибированию адгезии клеток KTC-26 и A498 к коллагену ( рис. 6A ). Однако адгезия клеток Caki-1 к коллагену не была существенно затронута. Блокирование интегрина α5 привело к снижению хемотаксической активности во всех трех линиях клеток ( рис. 6B ). Блокирование рецептора α6 не оказало существенного влияния на адгезию к коллагену ни в одной из линий клеток ( рис. 6A ), но значительно снизило хемотаксис во всех трех линиях клеток ( рис. 6B ).
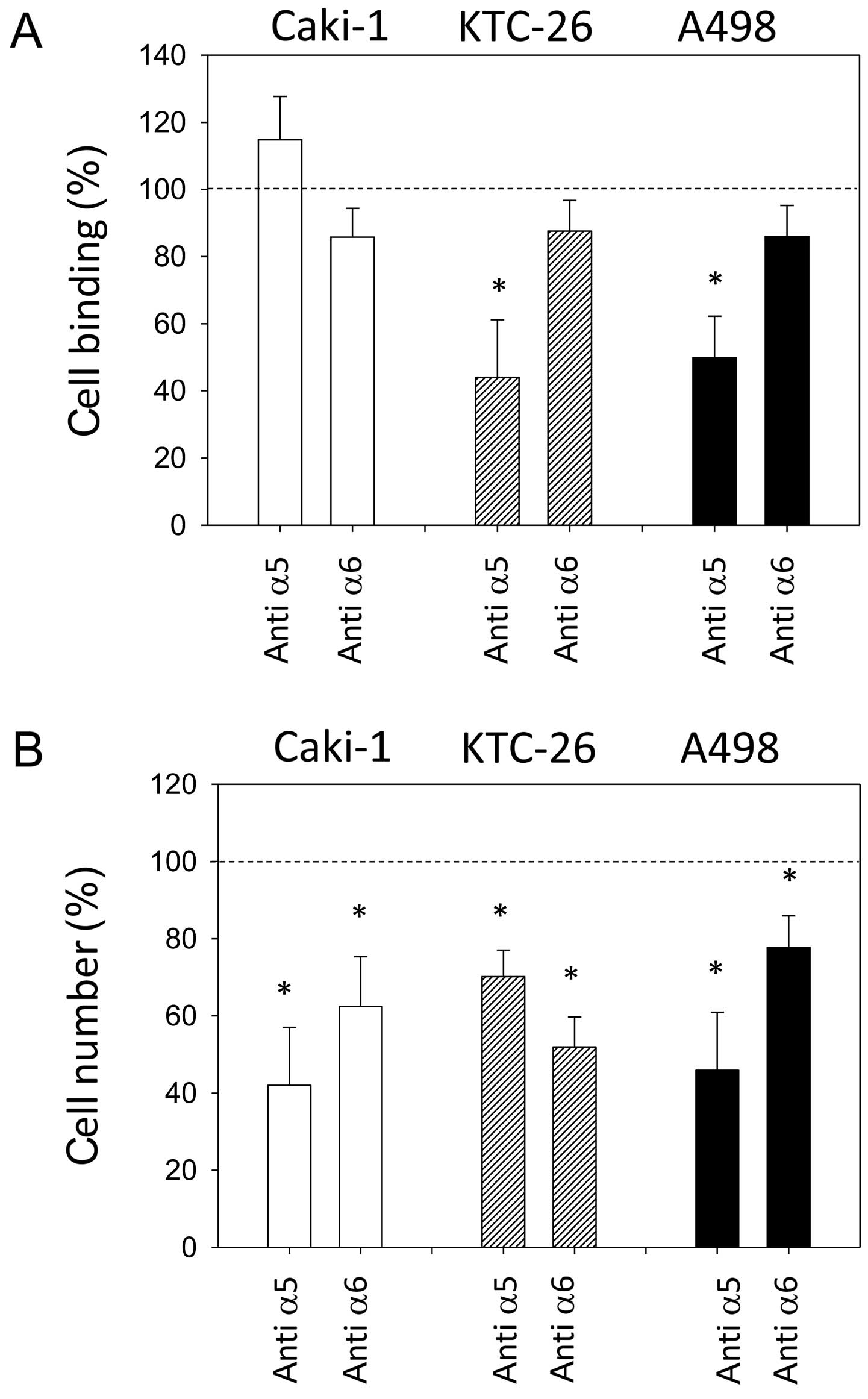 |
Рисунок 6Влияние функциональной блокировки интегрина α5 и α6 на (A) адгезию клеток к коллагену и (B) хемотаксис. Неблокированные клетки служили в качестве контроля (100%, пунктирная линия). Оценивалось среднее количество адгезированных или хемотаксически активных клеток из пяти полей (0,25 мм2). Полосы указывают среднее значение ± стандартное отклонение (SD). *Значительное различие с контролем. n=3 эксперимента, p≤0,05. |
Обсуждение
Было отмечено, что взаимодействие между опухолевыми клетками и эндотелием играет решающую роль в метастатической прогрессии; адгезия клеток немелкоклеточного рака легких (НМРЛ) к эндотелию стенки сосудов была связана с трансмиграцией опухолевых клеток, что приводит к метастазам в мозг и лимфатические узлы ( 7 ). Более агрессивный, метастазирующий фенотип рака также был связан с повышенной адгезией ( 7 ). В настоящем исследовании мы продемонстрировали, что воздействие амигдалина привело к значительному ингибированию связывающего взаимодействия между клетками RCC и монослоем HUVEC, коллагеном и фибронектином. Таким образом, была ингибирована хемотаксическая и инвазивная активность клеток RCC. Такое ингибирование является клинически значимым, поскольку трансэндотелиальная миграция и подвижное распространение являются критическими этапами в распространении и прогрессировании опухоли ( 3 ) и коррелируют с плохой выживаемостью. Снижение миграционного потенциала было связано с успешной терапией опухолей и менее злокачественным фенотипом опухоли ( 8 ). Таким образом, мы предполагаем, что ингибирование адгезии и подвижности клеток почечно-клеточного рака амигдалином снижает распространение метастазов.
Эффект амигдалина на блокирование адгезии и миграции не ограничивается клетками почечно-клеточного рака. Недавно было показано, что амигдалин также подавляет адгезивное поведение клеток рака мочевого пузыря ( 5 ). Хотя амигдалин оказывал схожее подавляющее действие на адгезионные свойства клеток рака мочевого пузыря и почечно-клеточного рака, миграция клеток рака мочевого пузыря была затронута амигдалином по-разному. Хемотаксис был подавлен в двух, но повышен в одной линии клеток рака мочевого пузыря после воздействия амигдалина, что указывает на то, что влияние амигдалина, вероятно, зависит от сущности опухоли. Таким образом, важно исследовать влияние амигдалина на различные сущности опухоли.
Семейство интегринов вовлечено во все этапы метастатической прогрессии опухоли ( 4 , 7 ). Интегрин α5 повышается в опухолевых клетках эпителиального происхождения, и была установлена положительная корреляция между экспрессией интегрина α5 и адгезией клеток почечно-клеточного рака ( 9 ). В настоящем исследовании введение амигдалина значительно снизило поверхностный интегрин α5 во всех трех клеточных линиях. Кроме того, общее клеточное содержание интегрина α5 в зависимости от времени снижалось в присутствии амигдалина. Блокирование функции интегрина α5 вызвало значительное ингибирование адгезии клеток KTC-26 и A498 к коллагену и снижение хемотаксической активности всех используемых клеточных линий. В соответствии с настоящими данными, снижение регуляции интегрина α5 ранее было связано со снижением адгезивного и инвазивного поведения нескольких типов раковых клеток ( 10–12 ) .
В настоящем исследовании мы отметили, что адгезия коллагена клеток Caki-1 не снизилась после блокирования интегрина α5, в отличие от вызванного амигдалином снижения в клетках A498 и KTC-26. Подобное различие в функции интегрина между типами опухолевых клеток наблюдалось ранее. Было показано, что блокирование интегрина α5 ингибирует взаимодействие клеток с матриксом клеток рака мочевого пузыря HCV29 и BC3726, но усиливает связывание линий клеток рака мочевого пузыря T24 и Hu456 (оснащенных другим набором интегринов) ( 13 ). Аналогичным образом, было показано, что блокирование интегрина β1 ингибирует прикрепление клеток рака мочевого пузыря UMUC-3 к коллагену, но оказывает противоположный адгезивный эффект на клетки TCCSUP, которые характеризуются другим профилем экспрессии интегринов ( 5 ). В настоящем исследовании воздействие амигдалина вызвало увеличение поверхностного β3 интегрина в клетках KTC-26 и A498, но уменьшение в клетках Caki-1. Контррегуляция с участием другого подтипа интегрина, в данном случае β3, может объяснить, почему блокирование α5 не остановило адгезию в клетках Caki-1. Потеря интегрина α5 вызвала снижение хемотаксиса во всех трех клеточных линиях. Поэтому мы предполагаем, что потеря поверхностного интегрина α5 является механизмом, посредством которого амигдалин действует на миграцию клеток RCC, а тонкая настройка производительности интегрина зависит от конкретного профиля интегрина в конкретной клеточной линии.
Было показано, что интегрин α6 облегчает миграцию эпителиальных клеток и коррелирует с риском прогрессирования, метастазирования и смерти в клинических испытаниях ( 14 ). Другие исследования показали, что интегрин α6 способствует миграции и инвазии при колоректальном раке ( 15 ), а также карциномах поджелудочной железы ( 16 ) и молочной железы ( 17 ). Было отмечено, что интегрин α6 активирует FAK ( 18 ) и связанную с FAK нисходящую сигнализацию, которая имеет отношение к контролю подвижности клеток, выживаемости и пролиферации ( 4 ). В настоящем исследовании поверхностная экспрессия интегрина α6 была значительно снижена, а FAK был дезактивирован амигдалином во всех трех клеточных линиях. Блокирование поверхностного интегрина α6 показало, что α6 не мешает адгезии опухолевых клеток, но регулирует подвижность клеток. Поэтому вполне вероятно, что снижение α6 представляет собой механизм, с помощью которого амигдалин замедляет распространение клеток.
Было показано, что интегрин β1 способствует инвазии клеток при раке молочной железы, легких, поджелудочной железы и колоректальном раке, а также при глиоме, меланоме ( 4 ) и нейробластоме ( 19 ). В клетках рака предстательной железы было показано, что повышение уровня интегрина β1 сопровождается повышенным подвижным поведением, тогда как блокада интегрина β1 способствует снижению хемотаксиса, миграции и адгезии клеток ( 10 ). Ингибирование интегрина β1 было связано с уменьшением инвазии и метастазирования рака яичников ( 12 ), а ингибитор пептида интегрина α5β1, как было показано, блокирует метастазирование рака молочной железы in vivo ( 20 ). В настоящем исследовании поверхностный интегрин β1 был снижен во всех трех линиях опухолевых клеток после 2 недель воздействия амигдалина. Таким образом, амигдалин может воздействовать на интегрин β1, замедляя подвижное распространение клеток почечно-клеточного рака.
Исследования in vitro и in vivo показывают, что α3 является еще одним интегрином, участвующим в инвазии глиомы, меланомы, гепатоцеллюлярной и молочной карциномы, а также способствует метастазированию клеток молочной железы в легкие ( 4 ). Блокирование интегрина α3 привело к ингибированию адгезии клеток рака простаты ( 21 ). В настоящем исследовании поверхностный интегрин α3 был снижен в клетках Caki-1 и KTC-26, но не в клетках A498. Это неоднородное снижение указывает на специфичный для клеточной линии эффект, вызванный амигдалином.
Применение амигдалина, помимо модуляции экспрессии поверхностного интегрина, также изменило общее содержание клеточного интегрина. В настоящем исследовании общая экспрессия клеточного интегрина α2 была повышена во всех трех линиях опухолевых клеток после воздействия амидалина. Предыдущие исследования показали, что снижение уровня интегрина α2 в опухолевых клетках потенциально увеличивает распространение опухолевых клеток, а повторная экспрессия интегрина α2, как было показано, обращает вспять злокачественные свойства клеток рака молочной железы ( 22 ). Следовательно, мы предполагаем, что индуцированное амигдалином ингибирование адгезии и миграции опухолевых клеток, наблюдаемое здесь, связано с повышением регуляции интегрина α2.
Общий клеточный интегрин α3 снизился через 24 ч после нанесения амигдалина во всех трех клеточных линиях. Это согласуется с вызванным амигдалином снижением поверхностного α3 в клетках Caki-1 и KTC-26. Поскольку поверхностный α3 не был изменен в клетках A498, возможно, что амигдалин в этой клеточной линии действует через внутриклеточные сигнальные пути α3. p-FAK, который был сильно снижен в клетках A498 через 24 ч после нанесения амигдалина, подтверждает эту гипотезу, поскольку ось α3-FAK участвует в инициации и прогрессировании рака ( 23 ). Ли и др. продемонстрировали, что FAK является критическим медиатором опухолеобразования и метастазирования, которые частично зависят от интегрина α3 ( 24 ). Поэтому мы предполагаем, что снижение как интегрина α3, так и FAK дезактивирует двигательный аппарат клеток A498.
Общий клеточный интегрин β1 был повышен в клетках Caki-1 после применения амигдалина, в то время как поверхностная экспрессия была снижена. Этот тип сдвига не является необычным и указывает на транслокацию рецептора с поверхности во внутриклеточный компартмент. Хотя значимость этого процесса не полностью понята, было показано, что перемещение интегрина β1 к плазматической мембране увеличивает метастатический потенциал клеток RCC, тогда как остановка рециркуляции β1 путем поддержания высокого содержания цитоплазматической и низкого содержания плазматической мембраны снижает метастазирование ( 25 ). Было показано, что повышение внутриклеточного β1 связано с дезактивацией FAK ( 25 ), что коррелирует с настоящими результатами.
Эффекты амигдалина на экспрессию подтипа интегрина зависели от клеточной линии, от того, было ли время применения острым (24 ч) или хроническим (2 недели) и от того, находился ли интегрин на поверхности клетки или в цитоплазме. Таким образом, молекулярный способ действия амигдалина в отношении экспрессии подтипа интегрина не является однородным и может влиять как на механическое межклеточное сцепление, запускаемое интегрином, так и на активацию биохимического пути, контролируемого интегрином.
В трех исследованных линиях клеток RCC применение амигдалина значительно снизило инвазивное и подвижное поведение. Однако 2 недели применения амигдалина не снизили инвазивную способность клеток KTC-26. Снижение было преимущественно связано с уменьшением поверхностных интегринов α5 и α6. Однако этот механизм не следует обобщать. Хотя было показано, что амигдалин также ингибирует адгезию и миграцию в клетках рака мочевого пузыря, интегрины изменяются по-разному. Интегрины α5 и α6, по-видимому, являются важной мишенью амигдалина в клетках RCC, тогда как модуляция интегринов β1 или β4 была наиболее очевидна в клетках рака мочевого пузыря ( 5 ). Были начаты дальнейшие исследования in vitro , чтобы оценить, влияет ли амигдалин также на рост клеток RCC, как это наблюдалось для клеток рака мочевого пузыря ( 6 ).
В заключение, воздействие амигдалина на клетки RCC подавляет метастатическое распространение и связано с подавлением α5 и α6 интегринов. Таким образом, амигдалин проявляет противоопухолевую активность in vitro в RCC. Эта активность in vitro должна быть оценена на модели животных.
Благодарности
Настоящее исследование было поддержано «Фондом Бригитты и Норберта Мут» и «Друзья и сторонники Франкфуртского университета Гете».
ВЛИЯНИЕ ДИХЛОРАЦЕТАТА НА РОСТ И МЕТАСТАЗИРОВАНИЕ КАРЦИНОМЫ ЛЕГКИХ ЛЬЮИСА
ВЛИЯНИЕ ДИХЛОРАЦЕТАТА НАТРИЯ НА РОСТ И МЕТАСТАЗИРОВАНИЕ КАРЦИНОМЫ ЛЕГКИХ ЛЬЮИСА
Д.Л. Колесник1, О.Н. Пясковская1, И.В. Бойчук1, О.И. Дасюкевич1, О.Р. Мельников1, А.С. Тарасов1, Г.И. Соляник1
1Институтэкспериментальной патологии, онкологии и радиобиологии имени
Р.Е. Кавецкого НАН Украины, Киев 03022, Украина.
Корреспонденция: Д.Л. Колесник, E-mail: deniskol@mail.ru
Поступила в редакцию: 20 марта 2015 г
Аннотация
Отличительной чертой злокачественных опухолей является чрезмерный гликолиз опухоли, даже в присутствии кислорода, что вызывает лактацидоз в микроокружении опухоли и способствует пролиферации и выживанию опухолевых клеток. По этой причине антиметаболические агенты, направленные на метаболизм опухолевых клеток, активно исследуются как перспективные противораковые препараты. Цель: изучить влияние лактацидоза на выживание клеток карциномы легких Льюиса (LLC) в условиях дефицита питательных субстратов in vitro и оценить противоопухолевую и антиметастатическую активность против LLC/R9 in vivo. Материалы и методы: В качестве экспериментальной опухолевой модели использовали вариант LLC/R9. Жизнеспособность опухолевых клеток определяли с помощью окрашивания трипановым синим. Уровень апоптоза подсчитывали с помощью красителя Hoechst 33258. Содержание лактата в опухолевой ткани оценивали ферментным методом с использованием лактатдегидрогеназы. Реактивные виды кислорода определяли с помощью 2,7-дихлорфлуоресцеин диацетата. Влияние дихлорацетата (ДХА) на рост и метастазирование LLC/R9 анализировали с помощью рутинных процедур. Оценка влияния ДХА на компоненты электронно-транспортной цепи (ЭТЦ) проводилась с помощью ЭПР. Результаты: Показано, что в условиях лактацидоза и дефицита глюкозы жизнеспособность клеток LLC/R9 in vitro была выше на 30% (р < 0,05), а уровень апоптоза был в три раза ниже (р < 0,05), чем эти показатели в условиях только дефицита глюкозы. У мышей с пересаженными опухолями LLC/R9, которых в течение 3 недель per os лечили DCA в общей дозе 1,5 г/кг массы тела, начиная со следующего дня после пересадки опухоли, объем первичной опухоли был всего на 30% меньше, чем в контрольной группе. В то же время количество и объем метастазов в легких у животных, получавших DCA, были на 59% (р < 0,05) и 94% (р < 0,05) ниже, соответственно, чем эти показатели в контрольной группе. Лечение DCA привело к увеличению содержания лактата в опухолевой ткани почти на 30% (р < 0,05) по сравнению с контролем, но не оказало существенного влияния на уровни комплексов гемового железа с NO (при gmed = 2,007) в белках митохондриального ЭТЦ и белков Fe-S кластера (при g = 1,94) в опухолевых клетках. Выводы: Показано, что лактацидоз значительно способствовал выживанию клеток LLC/R9 в условиях дефицита глюкозы in vitro. При развитии LLC/R9 in vivo DCA, как соединение с антилактацидозной активностью, не подавлял существенно рост первичной опухоли, но обладал значительной антиметастатической активностью.
Ключевые слова: дихлорацетат; гипоксическая радиочувствительность; рак молочной железы; реактивные виды кислорода
Сокращения: DCA — дихлорацетат, ETC — электронно-транспортная цепь; LLC/R9 — вариант карциномы легких Льюиса; PDH — пируватдегидрогеназа; PDK — киназа пируватдегидрогеназы.
ВВЕДЕНИЕ
Хорошо известно, что лактацидоз, большое накопление лактата и снижение рН, является основной характеристикой метаболического микроокружения опухолевых клеток in vitro и in vivo. Ранее лактацидоз рассматривался как балластный продукт метаболизма опухолевых клеток. Однако недавно было показано, что он может использоваться опухолевыми клетками в качестве эффективного энергетического топлива и быть одним из факторов, ответственных за устойчивость опухоли к дефициту глюкозы [1-3]. Как мы показали на примере клеток карциномы легких Льюиса (LLC)/R9, варианта LLC, чувствительного к антиангиогенной терапии рака [4,5], лактацидоз может способствовать выживанию опухолевых клеток в условиях дефицита питания. Такие условия были созданы путем длительной инкубации опухолевых клеток без замены культуральной среды (модель «непитательной культуры») [6]. Изучение кинетики роста опухолевых клеток в условиях «непитательной культуры» показало, что на фоне полного отсутствия глюкозы в инкубационной среде на 7-8 день роста клеток количество жизнеспособных клеток не падало ниже третьей части от максимума, зарегистрированного на 3-4 день, и оставалось практически на этом уровне до10 дня. Высокая выживаемость клеток LLC/R9 в условиях «некормленой культуры» была связана, в частности, со способностью этих клеток к макроавтофагии. Однако нельзя исключить, что способность клеток LLC/R9 к адаптации к дефициту питательных субстратов определялась лактацидозом, развившимся вследствие длительного культивирования опухолевых клеток без замены инкубационной среды.
Если лактацидоз способен повышать выживаемость опухолевых клеток, то соединения, подавляющие образование лактацидоза в опухолевом микроокружении, в частности, дихлорацетат (ДХА) как соединение с антилактацидозной активностью, должны проявлять противоопухолевую активность. Настоящее исследование было направлено на проверку этого предположения.
Известно, что DCA является ингибитором киназы пируватдегидрогеназы (PDK), поэтому его рассматривают как негативный регулятор ферментов митохондриального комплекса пируватдегидрогеназы (PDH), который играет ключевую роль в регуляции трикарбоновых кислот и окислительного фосфорилирования [7]. Если комплекс PDH фосфорилирован, вход пирувата в цикл Кребса ингибируется, поэтому активируется гликолиз. Благодаря ингибированию PDK, DCA способен привести к непрямой активации ферментов комплекса PDH и, соответственно, вызвать сдвиг энергетического баланса клетки от гликолиза в сторону активации окислительного фосфорилирования. Поэтому DCA широко используется для коррекции лактации, вызванной высокой интенсивностью гликолиза или дефектом клеточного дыхания.
Согласно литературным данным, способность ДКА активировать окислительное фосфорилирование лежит в основе его противоопухолевой активности и реализуется, в частности, через снижение лактацидоза и индукцию реактивных форм кислорода (ROS) [8-12]. Целью нашего исследования был анализ влияния лактацидоза на выживаемость клеток LLC/R9 в условиях дефицита питательных веществ in vitro и оценка противоопухолевой и антиметастатической активности DCA против LLC/R9 in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные животные, опухолевые клетки
В исследовании использовали 2,0-2,5-месячных мышей линии C57Bl/6 весом 18-23 г, выращенных на базе Института экспериментальной патологии, онкологии и радиобиологии имени Р.Е. Кавецкого НАН Украины. Протоколы исследований и процедуры работы с животными проводились в соответствии с основными требованиями к содержанию и работе с лабораторными животными и правилами местного комитета по биоэтике.
В исследовании использовали вариант LLC LLC/R9, полученный из штамма LLC дикого типа путем 9 последовательных сеансов химиотерапии in vivo на основе цис-диамминдихлороплатина (цис-ДДП) [13]. Клетки LLC/R9 поддерживали в культуральной среде RPMI (Sigma, США), дополненной 10% фетальной телячьей сывороткой (FCS) (Sigma, США), и 40 мг/мл гентамицина при 37 °C в увлажненной атмосфере с 5%CO2.
Эксперименты in vitro
Количество клеток в суспензии и их жизнеспособность регулярно анализировали на гемоцитометре с использованием теста исключения трипанового синего.
Для оценки влияния лактацидоза на жизнеспособность клеток LLC/R9, 1,5-105 клеток/лунку высевали в 24-луночный планшет в среду RPMI 1640 (Sigma, США) со стандартным содержанием глюкозы. После ночной инкубации клеток инкубационную среду заменяли свежей средой с различным содержанием глюкозы, лактата и с различным pH для моделирования условий дефицита глюкозы, лактацидоза на фоне дефицита глюкозы, а также стандартной (табл. 1). Глюкозодефицитную среду готовили на основе среды RPMI 1640 без глюкозы (Sigma, США). Лактацидоз генерировали путем добавления чистой молочной кислоты (Sigma, США) в среду с дефицитом глюкозы до конечной концентрации 14 ± 0,7 мМ и рН 6,7.
| Среда | Содержание глюкозы, мМ |
Содержание лактата, мМ | рН |
|---|---|---|---|
| Стандарт | 9.0 ± 0.5 | 1.6 ± 0.1 | 7.4 ± 0.01 |
| Дефицит глюкозы | 3.0 ± 0.1 | 1.6 ± 0.1 | 7.4 ± 0.01 |
| Лактацидоз | 3.0 ± 0.1 | 14.0 ± 0.7 | 6.7 ± 0.01 |
Таблица 1. Содержание глюкозы, лактата и рН культуральных сред, использованных в исследовании
Влияние различных условий инкубации на выживаемость опухолевых клеток, производство ROS, потребление глюкозы и производство лактата оценивали на2-й день инкубации опухолевых клеток.
Содержание глюкозы в культуральной среде и в гомогенатах опухолевой ткани определяли ферментным глюкозооксидантным методом с использованием набора для анализа глюкозы в биологических жидкостях (Sigma, США) согласно инструкции производителя. Содержание лактата в инкубационной среде и в гомогенатах опухолевой ткани определяли методом ферментной спектрофотометрии с использованием лактатдегидрогеназы (Sigma, США) [14]. Образцы среды и опухолевых тканей собирали и хранили при -20 °С или в жидком азоте, соответственно, до проведения измерений.
Уровень апоптоза в опухолевых клетках анализировали с использованием красителя Hoechst 33258 (Sigma, США) и флуоресцентной микроскопии по стандартной методике.
Продукцию ROS в опухолевых клетках определяли с использованием 2,7-дихлорфлуоресцеин диацетата (Sigma, США) методом спектрофлуорометрии (возбуждение при 495 нм, эмиссия при 530 нм) согласно [15].
Все измерения были повторены.
Эксперименты in vivo
Для экспериментов in vivo клетки LLC/R9 размножали in vitro в стандартных условиях и инокулировали i.m. мышам (1,0-106 клеток/животное в 0,1 мл раствора Хенкса).
После инокуляции клеток LLC/R9 животных распределили на 2 группы: группа 1 — мыши, обработанные DCA (Sigma, США) в общей дозе 1,5 г/кг (LD50/3) (n = 13); группа 2 — мыши, обработанные водой в том же режиме и в том же объеме (контроль, n = 12).
Лечение было начато на следующий день после трансплантации опухолевых клеток по метрономическому режиму, 5 раз в неделю в течение 3 недель. DCA готовили ex tempore в воде и вводили per os в объеме 0,4 мл/животное.
Объем первичной опухоли рассчитывали на основании ее диаметра, измеряемого штангенциркулем каждый3-й день, начиная с10-го дня после инокуляции опухолевых клеток, по формуле:
V = π (d)3/6,
где d — диаметр опухоли (мм).
Уровень метастазирования у мышей, несущих опухоль, оценивали на 21-й день после инокуляции опухолевых клеток по количеству и объему метастазов в легких с помощью бинокулярного микроскопа и миллиметровой шкалы.
Общий объем метастазов рассчитывали по формуле:
V = Σ niπ(di)3/6,
где V — общий объем метастазов (мм3), ni — количество метастазов с диаметромdi (мм).
Анализ функциональной активности компонентов дыхательной цепи митохондрий в опухолевых клетках проводили с использованием ЭПР на21-е сутки после инокуляции опухолевых клеток. Опухолевую ткань нарезали на образцы специального размера (d = 4,0 мм, l = 25-35 мм), замораживали и хранили при температуре -70 °С. ЭПР-анализ образцов проводили при 77 К на спектрофотометре Е-109 Varian (США) при скорости развертки потенциала 500 Е/мин, амплитуде модуляции 1,25×10 Е, мощности СВЧ-облучения 10.0 мВт, постоянном сеансе работы аппарата 1,0 с. По данным спектров ЭПР определяли уровни комплексов гемового железа с NO (при gmed = 2,007) в белках ЭТЦ митохондрий и белков Fe-S кластера (при g = 1,94) в опухолевых клетках.
Статистический анализ полученных результатов проводили с помощью описательных методов, нелинейного регрессионного анализа и t-теста Стьюдента с использованием программ Microsoft Excel и Microcal Origin.
РЕЗУЛЬТАТЫ
Было показано, что лактацидоз в условиях дефицита глюкозы значительно способствовал выживанию клеток LLC/R9. Действительно, кинетика роста опухолевых клеток, инкубированных в условиях лактацидоза на фоне дефицита глюкозы, существенно не отличалась от таковой у клеток, инкубированных в среде со стандартным содержанием глюкозы, по крайней мере, в период их экспоненциального роста. В частности, количество жизнеспособных клеток на2-е сутки инкубации в условиях лактацидоза на фоне дефицита глюкозы было практически таким же, как и в случае инкубации клеток в среде со стандартным содержанием глюкозы. В то же время в обоих случаях (лактацидоз и стандарт) количество жизнеспособных клеток было почти на 30% (р < 0,05) выше, чем при инкубации клеток в условиях дефицита глюкозы (рис. 1, а).
Кроме того, количество апоптотических клеток в условиях лактацидоза также статистически не отличалось от показателя в случае инкубации клеток в среде со стандартным содержанием глюкозы и на2-е сутки было равно 8,5 ± 0,9%, тогда как в условиях дефицита глюкозы количество апоптотических клеток было почти в три раза выше (р < 0,05), чем в случае лактацидоза (рис. 1, б).
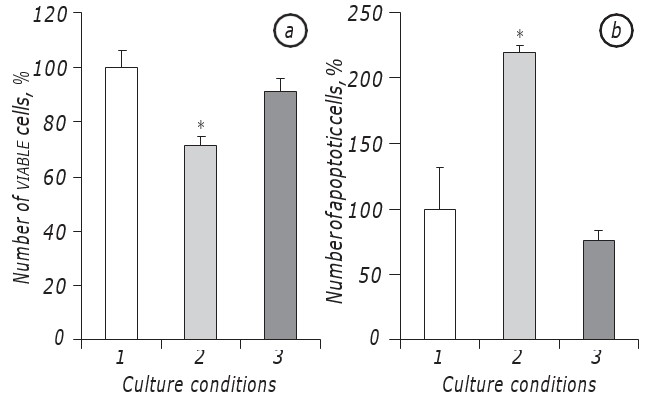 Рис. 1. Выживаемость клеток LLC/R9 на2-й день инкубации в стандартной (1), глюкозодефицитной (2) и лактацидозной (3) средах; а — количество жизнеспособных клеток; б — уровень апоптоза. *p < 0,05 по сравнению с контролем
Рис. 1. Выживаемость клеток LLC/R9 на2-й день инкубации в стандартной (1), глюкозодефицитной (2) и лактацидозной (3) средах; а — количество жизнеспособных клеток; б — уровень апоптоза. *p < 0,05 по сравнению с контролем
Интересно, что в условиях лактацидоза в клетках LLC/R9 потребление глюкозы было значительно ниже. Низкая скорость потребления глюкозы опухолевыми клетками при лактацидозе, зарегистрированная только на1-е сутки инкубации, восстанавливалась на2-е сутки и была на 70% ниже (p < 0,05), чем в случае среды со стандартным содержанием глюкозы (табл. 2). В случае дефицита глюкозы в противоположность лактацидозу на2-е сутки уровень глюкозы в инкубационной среде падал до нуля, что дополнительно свидетельствовало о снижении потребления глюкозы клетками LLC/R9 в условиях лактацидоза.
В то время как лактацидоз приводил к снижению скорости потребления глюкозы клетками LLC/R9, уровень внутриклеточных ROS в клетках, выживших в таких условиях, значительно возрастал. Эти данные представлены в таблице 2 и показывают, что уровень ROS в клетках, инкубированных в условиях лактацидоза, был почти на 150% (p < 0,05) и 230% (p < 0,05) выше соответствующих показателей для клеток, инкубированных в стандартной и глюкозодефицитной среде, соответственно.
Таким образом, полученные данные показали, что лактацидоз значительно способствовал выживанию клеток LLC/R9 в условиях дефицита глюкозы in vitro, что подтверждается высоким числом выживших в таких неблагоприятных условиях клеток и низким уровнем апоптоза. Выживание клеток было связано с неожиданным повышением уровня внутриклеточного ROS и снижением потребления глюкозы в LLC/R9.
| Среда | Потребление глюкозы, % | ROS, % |
|---|---|---|
| Стандарт | 100.0 ± 5.9 | 100.0 ± 24.8 |
| Дефицит глюкозы | 0.0 ± 0.0* | 75.8 ± 10.7 |
| Лактацидоз | 29.8 ± 1.5* | 248.7 ± 53.2* |
Таблица 2. Влияние лактацидоза в условиях дефицита глюкозы на потребление глюкозы и продукцию ROS опухолевыми клетками in vitro.
Примечание: *p < 0,05.
Данные закономерности выживания клеток LLC/R9 в условиях лактацидоза на фоне дефицита глюкозы in vitro свидетельствовали о том, что снижение содержания лактата в опухолевом микроокружении может препятствовать выживанию опухолевых клеток в условиях метаболического стресса, оказывая противоопухолевый эффект. Эта гипотеза была проверена нами с использованием DCA как соединения, способного уменьшать лактацидоз.
Данные о влиянии DCA на кинетику роста и метастазирование LLC/R9 представлены на рис. 2 и в табл. 3. Согласно этим данным, DCA не оказывал существенного влияния на рост первичных опухолей, но вызывал выраженное подавление метастазирования. Кинетика роста первичных опухолей у мышей с LLC/R9, обработанных ДКА, практически не отличалась от таковой у контрольных мышей, и на21-й день после пересадки опухоли объем первичных опухолей в опытной группе был всего на 39% меньше, чем в контрольной (см. рис. 2, табл. 3). Несмотря на то, что DCA не подавлял рост первичной опухоли, его антиметастатическая активность в отношении LLC/R9 оказалась поразительной. Количество и объем метастазов в легких у мышей с опухолью, получавших DCA, были на 59% (р < 0,05) и 94% (р < 0,05) ниже, чем эти показатели в контрольной группе, соответственно (см. табл. 3).
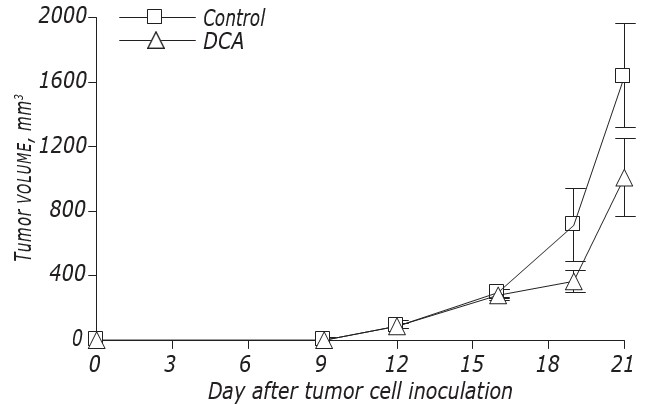 Рис. 2. Влияние DCA на кинетику роста LLC/R9 in vivo
Рис. 2. Влияние DCA на кинетику роста LLC/R9 in vivo
| Группа мышей | Объем опухоли, мм3 | Количество метастазов | Объем метастазов, мм3 |
|---|---|---|---|
| Контроль (n = 13) | 1702.7 ± 333.9 | 10.9 ± 1.2 | 17.9 ± 5.6 |
| ДКА (n = 13) | 1046.0 ± 258.3 | 4.5 ± 1.6* | 1.1 ± 0.4* |
Таблица 3. Влияние DCA на рост и метастазирование LLC/R9.
Примечание: *р < 0,05, различия значительны по сравнению со значением для контроля.
Анализ содержания лактата в образцах опухолевой ткани показал, что неожиданно DCA вызвал значительное увеличение содержания лактата в опухолевой ткани, по крайней мере, на21-й день после пересадки опухоли. Как видно из таблицы 4, содержание лактата в опухолевой ткани мышей, получавших DCA, было почти на 30% выше (р < 0,05), чем в контроле. Учитывая способность DCA как ингибитора PDH-киназы реорганизовывать энергетический метаболизм злокачественной опухоли в сторону окислительного фосфорилирования, мы рассматривали продукцию лактата опухолевыми клетками как суррогатный маркер ингибирования гликолиза при воздействии DCA. Повышение уровня лактата в опухоли под действием DCA показало, что его введение мышам с LLC/R9 в общей дозе 1,5 г/кг массы тела животного может быть недостаточным для активации окислительного фосфорилирования в опухолевых клетках, что отчасти объясняет его низкую эффективность против первичных опухолей.
| Группа мышей | Лактат (мкмоль/1 г ткани) |
|---|---|
| Контроль (n = 4) | 11.1 ± 0.6 |
| ДКА (n = 5) | 14.4 ± 1.5* |
Таблица 4. Влияние DCA на уровень лактата в опухолевой ткани мышей-носителей LLC/R9.
Примечание: р < 0,05, различия значительны по сравнению со значением для контроля.
Анализ спектров ЭПР опухолевых образцов показал, что ДКА не оказывал существенного влияния на функциональное состояние компонентов ЭТЦ в митохондриях опухолевых клеток (табл. 5). Например, у мышей с LLC/R9, леченных ДКА, интенсивность сигналов ЭПР, соответствующих белковым комплексам нитрозил-гемовое железо (gсер = 2,007) в белках ЭТК митохондрий опухолевых клеток, не была существенно выше, чем у контрольных мышей. Известно, что накопление NO-комплексов гемового железа может свидетельствовать, с одной стороны, о редокс-дисбалансе в сторону доминирования свободнорадикальных процессов, в частности, гиперпродукции NO, а с другой — о возможном ингибировании клеточного дыхания через нитрозилирование гемовых белков. Однако DCA, основной механизм противоопухолевого действия которого, как считается, связан с индукцией продукции ROS митохондриями [8, 10, 11], не вызывал повышения уровня комплексов железа гема с NO в опухолевой ткани. Последнее наблюдение, возможно, связано с особенностями клеток LLC/R9, а именно с чрезвычайно высоким содержанием этих комплексов, характерным для этой опухоли, прогрессивное накопление которых в процессе развития опухоли in vivo было зарегистрировано нами даже в отсутствие лечения [16].
| Относительная интенсивность сигнала ЭПР | Относительная интенсивность сигнала ЭПР | |
| Группа мышей | Нитрозил-гемовые белковые комплексы железа (g = 2,007) | Fe-S белок (g = 1.94) |
| Контроль | 54.3 ± 4.5 | 15.8 ± 0.5 |
| DCA | 97.8 ± 30.1 | 17.8 ± 2.1 |
Таблица 5. Влияние DCA на активность митохондриального ЭТЦ опухолевых клеток
Отсутствие существенного влияния ДКА на функциональную активность компонентов митохондриального ЭТЦ в опухолевых клетках подтверждается также данными об интенсивности сигналов ЭПР, соответствующих белкам Fe-S-кластера (g = 1,94) (комплексы І, ІІ, ІІІ), которая была практически одинаковой в обеих группах животных (см. табл. 5).
В заключение, результаты нашего исследования показали, что лактацидоз значительно способствовал выживанию варианта LLC LLC/R9 в условиях дефицита глюкозы. В то же время при развитии LLC/R9 in vivo DCA не оказывал противоопухолевой активности против первичных опухолей. Отсутствие противоопухолевого действия DCA против роста LLC/R9 согласуется с отсутствием ингибирующего эффекта DCA на содержание лактата в опухоли, а также с отсутствием заметного влияния DCA на продукцию ROS опухолевыми клетками. Хотя DCA не влиял на рост LLC/R9, но резко подавлял метастазирование, это наблюдение не может быть объяснено действием DCA в первичной опухоли, и требуются дальнейшие дополнительные исследования его антиметастатического действия.
ССЫЛКИ
1 Feron O. Пируват в лактат и обратно: от эффекта Варбурга до симбиотического обмена энергетического топлива в раковых клетках. Radiother Oncol 2009; 92: 329-33. doi: 10.1016/j.radonc.2009.06.025.
2 Wu H, Ding Z, Hu D, et al. Центральная роль молочнокислого ацидоза в устойчивости раковых клеток к вызванной недостатком глюкозы клеточной гибели. J Pathol 2012; 227: 189-99. doi: 10.1002/path.3978.
3 Fiaschi T, Marini A, Giannoni E, et al. Reciprocal metabolic reprogramming through lactate shuttle coordinately influences tumor-stroma interplay. Cancer Res 2012; 72: 5130-40.
4 Соляник Г.И., Федорчук А.Г., Пясковская О.Н., и др. Противораковая активность аконитинсодержащего растительного экстракта BC1. Exp Oncol 2004; 26: 307-11.
5 Пясковская О.Н. Антиангиогенное действие циклофосфамида на экспериментальные метастатические опухоли. J Med Chem 2012; 2: 25-9 (на украинском языке).
6 Колесник Д. Л., Пясковская О. Н., Трегубова Н. В., Соляник Г. И. Вариант карциномы легких Льюиса с высокой чувствительностью к противоопухолевой антиангиогенной терапии проявляет высокую способность к аутофагии. Cytol Genet 2012; 46: 155-60. doi: 10.3103/S009545271203005X.
7 Stacpoole PW. Фармакология дихлорацетата. Metabolism 1989; 38: 1124-44.
8 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51.
9 Wong JY, Huggins GS, Debidda M, et al. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 2008; 109: 394-402. doi: 10.1016/j.ygyno.2008.01.038.
10 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010; 2: 31-4. doi: 10.1126/scitranslmed.3000677.
11 Stockwin LH, Yu SX, Borgel S, et al. Sodium dichloroacetate selectively target cells with defects in the mitochondrial ETC Int J Cancer 2010; 127; 2510-19.
12 Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma: Влияние измененного метаболизма глюкозы, гомеостаза рН и регуляции выживания клеток. Chem Biol Interact 2012; 199: 29-37.
13 Pyaskovskaya ON, Dasyukevich OI, Kolesnik DL, et al. Changes in VEGF level and tumor growth characteristics during Lewis lung carcinoma progression towards cis-DDP resistance. Exp Oncol 2007; 29: 197-202.
14 Биохимические методы (липидный и энергетический обмен). М.И. Прохорова, ред. Л.: Ленинградский университет, 1982. 272 p.
15 Wang H, Joseph JA. Количественная оценка клеточного окислительного стресса с помощью анализа на дихлорфлуоресцеин с использованием микропланшетного ридера. Free Radic Biol Med 1999; 27: 612-6.
16 Пясковская О.Н., Сорокина Л.В., Колесник Д.Л., и др. Динамика изменений показателей антиоксидантной системы в процессе роста двух вариантов карциномы легких Льюиса. Exp Oncol 2014; 36: 29-33.
Амигдалин подавляет рост клеток почечно-клеточной карциномы in vitro
Амигдалин подавляет рост клеток почечно-клеточной карциномы in vitro
- Авторы:
- Ева Юнгель
- Анита Томас
Аннотация
Хотя амигдалин используется многими онкологическими больными в качестве противоопухолевого средства, отсутствует информация об эффективности и токсичности этого природного соединения. В настоящем исследовании изучалось ингибирующее действие амигдалина на рост клеток почечно-клеточной карциномы (ПКР). Амигдалн (10 мг/мл) применялся к линиям клеток ПКР, Caki-1, KTC-26 и A498, в течение 24 часов или 2 недель. Необработанные клетки служили в качестве контроля. Рост и пролиферацию опухолевых клеток определяли с помощью тестов MTT и BrdU, а также оценивали фазы клеточного цикла. Экспрессия активирующих клеточный цикл белков cdk1, cdk2, cdk4, циклина A, циклина B, циклина D1 и D3, а также ингибирующих клеточный цикл белков p19 и p27 изучалась с помощью вестерн-блоттинга. Также исследовалась поверхностная экспрессия маркеров дифференциации E- и N-кадгерина. Функциональная блокада siRNA использовалась для определения влияния нескольких белков на рост опухолевых клеток. Лечение амигдалином вызвало значительное снижение роста и пролиферации клеток RCC. Этот эффект коррелировал с уменьшением процента клеток RCC в фазе G2/M и увеличением процента клеток в фазе G0/1 (Caki-1 и A498) или остановкой клеточного цикла в S-фазе (KTC-26). Кроме того, амигдалин вызвал заметное снижение белков, активирующих клеточный цикл, в частности cdk1 и циклина B. Функциональное блокирование cdk1 и циклина B привело к значительному снижению роста опухолевых клеток во всех трех линиях клеток RCC. Помимо ингибирующего воздействия на рост, амигдалин также модулировал маркеры дифференциации, E- и N-кадгерин. Следовательно, воздействие амигдалина на клетки RCC подавляло прогрессирование клеточного цикла и рост опухолевых клеток за счет нарушения экспрессии cdk1 и циклина B. Более того, мы отметили, что амигдалин влияет на маркеры дифференциации. Таким образом, мы предполагаем, что амигдалин оказывает противоопухолевое действие на ПКР in vitro.
Введение
Почечно-клеточная карцинома (ПКР) является наиболее распространенным раком почки и самой агрессивной урологической опухолью, и ее заболеваемость растет ( 1 ). Примерно у 15-20% пациентов с ПКР уже есть метастазы на момент постановки диагноза, в то время как у 30% пациентов метастазы развиваются во время терапии. После метастазирования прогноз для пациентов неблагоприятный. Расширение знаний о молекулярных механизмах действия ПКР способствовало разработке таргетной терапии в течение последнего десятилетия, тем самым улучшая прогноз для пациентов на поздних стадиях заболевания. Однако, несмотря на терапевтические достижения, прогноз для пациентов с ПКР остается неблагоприятным, 5-летняя выживаемость остается между 5 и 12% ( 2 , 3 ).
Большинство пациентов с прогрессирующим раком почки хотят активно участвовать в борьбе с раком и/или избегать неблагоприятных побочных эффектов, которые часто возникают при традиционной терапии. Поэтому многие пациенты обращаются к комплементарной и альтернативной медицине (КАМ). Более 50% онкологических больных в Европе ( 4 ) и до 80% онкологических больных в Соединенных Штатах ( 5 ) используют КАМ вместе с традиционной терапией или вместо нее.
Амигдалин (D-манделонитрил-β-гентиобиозид) — это природное соединение, которое часто используют онкологические больные. Он содержится в косточках абрикосов, персиков, яблок и горького миндаля ( 6–8 ). Первые исследования по использованию амигдалина онкологическими больными были проведены в России в 1840-х годах ( 9 ). В 1920-х годах амигдалин также назначали онкологическим больным в Соединенных Штатах ( 10 ). В 1950-х годах был представлен полусинтетический , химически иной производный амигдалина, лаэтрил. После появления лаэтрила термины амигдалин и лаэтрил часто использовались как синонимы, что затрудняло выводы из исследований, в которых не делалось различий между этими двумя соединениями ( 11 ) . В 1970-х годах амигдалин/леатрил стал одним из самых популярных нетрадиционных методов лечения рака. К 1978 году около 70 000 онкологических больных в США использовали амигдалин ( 12 ) . Национальный институт рака (NCI) инициировал несколько исследований ( 13–16 ) с отрезвляющими результатами. В резюме единственного испытания фазы II не было приписано существенной пользы амигдалину, в то время как было описано несколько пациентов с симптомами отравления цианидом (HCN) ( 13 ) . Однако качество этого исследования сомнительно, поскольку использовалась гетерогенная когорта пациентов, не были включены контрольные группы, а для внутривенной терапии использовался рацемат вместо чистого амигдалина. Все официальные суждения относительно амигдалина были основаны на этом испытании, поскольку никаких других клинических испытаний с амигдалином не доступно. Немецкий федеральный институт лекарственных средств и медицинских приборов (BfArM) ( http://www.bfarm.de/DE/Home/home_node.html ) также классифицировал амигдалин как сомнительный препарат, как и коллеги в других странах. Несмотря на противоречия и отсутствие научно обоснованных данных о пользе и рисках амигдалина, многие онкологические пациенты используют амигдалин ( 11 , 17 ). Таким образом, чтобы прояснить многие вопросы, на которые еще предстоит ответить относительно влияния амигдалина на рост и пролиферацию опухоли, в настоящем исследовании были определены прогрессия клеточного цикла и основные молекулярные режимы действия в клетках почечно-клеточного рака.
Материалы и методы
Клеточные культуры и лечение амигдалином
Линии клеток карциномы почки Caki-1, KTC-26 и A498 были приобретены у LGC Promochem (Wesel, Германия). Клетки выращивали и субкультивировали в среде RPMI-1640 (полученной у Seromed, Берлин, Германия) с добавлением 10% FCS, 20 мМ HEPES-буфера, 100 МЕ/мл пенициллина и 100 мкг /мл стрептомицина при 37°C в увлажненной атмосфере с 5% CO2 в инкубаторе. Субкультуры из пассажей 5–24 были отобраны для использования в экспериментах. Амигдалин из абрикосовых косточек (Sigma-Aldrich, Тауфкирхен, Германия) был свежерастворен в среде для культивирования клеток и затем добавлен к опухолевым клеткам в концентрации 10 мг/мл [ранее оцененной как оптимальная концентрация ( 18 )] на 24 часа или 2 недели (три раза в неделю) для оценки острого и хронического лечения. Контрольные группы оставались необработанными. Во всех экспериментах в настоящем исследовании обработанные культуры опухолевых клеток сравнивались с необработанными культурами опухолевых клеток. Для изучения токсического действия амигдалина жизнеспособность клеток определялась с помощью трипанового синего (Gibco/Invitrogen, Дармштадт, Германия).
Измерение роста, пролиферации и апоптоза опухолевых клеток
Рост клеток оценивали с помощью анализа восстановления красителя 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ) (Roche Diagnostics, Пенцберг, Германия). Клетки Caki-1 (50 мкл , 1×10 5 клеток/мл) высевали на 96-луночные планшеты для культивирования тканей. Через 24, 48 и 72 часа добавляли 10 мкл МТТ (0,5 мг/мл) еще на 4 часа. После этого клетки лизировали в буфере, содержащем 10% SDS в 0,01 М HCl. Планшеты инкубировали в течение ночи при 37°C, 5% CO 2 . Поглощение при 550 нм определяли для каждой лунки с помощью микропланшетного иммуноферментного анализа (ELISA). После вычитания фонового поглощения результаты выражались как среднее количество клеток.
Пролиферацию клеток измеряли с помощью набора для определения пролиферации клеток BrdU ELISA (Calbiochem/Merck Biosciences, Дармштадт, Германия). Опухолевые клетки, посеянные на 96-луночных планшетах, инкубировали с 20 мкл раствора для маркировки BrdU на лунку в течение 8 ч, фиксировали и детектировали с помощью анти-BrdU mAb в соответствии с инструкциями производителя. Поглощение измеряли при 450 нм с помощью ридера для микропланшетов ELISA.
Для оценки того, был ли рост опухолевых клеток нарушен или уменьшен из-за апоптоза, экспрессия аннексина V/пропидиум йодида (PI) была оценена с помощью набора Annexin V-FITC Apoptosis Detection kit (BD Pharmingen, Гейдельберг, Германия). Опухолевые клетки были дважды промыты PBS и затем инкубированы с 5 мкл Annexin V-FITC и 5 мкл PI в темноте в течение 15 минут при комнатной температуре. Клетки были проанализированы методом проточной цитометрии с использованием FACSCalibur (BD Biosciences, Гейдельберг, Германия). Процент апоптотических клеток (ранних и поздних) в каждом квадранте был рассчитан с помощью программного обеспечения CellQuest (BD Biosciences).
Процент клеток в разных фазах клеточного цикла
Анализ клеточного цикла проводился на субконфлюэнтных клеточных культурах. Популяции опухолевых клеток окрашивались PI с использованием набора реагентов CycleTEST PLUS DNA, а затем подвергались проточной цитометрии с использованием FACScan (оба от Becton-Dickinson, Гейдельберг, Германия). Из каждого образца было собрано 10 000 событий. Сбор данных проводился с использованием программного обеспечения CellQuest, а распределение клеточного цикла рассчитывалось с использованием программного обеспечения ModFit (Becton-Dickinson). Количество клеток с гейтированием в фазах G1, G2/M или S выражается в процентах.
Экспрессия белков, регулирующих клеточный цикл
Белки, регулирующие клеточный цикл, исследовали с помощью вестерн-блоттинга. Лизаты опухолевых клеток наносили на 7-15% полиакриламидный гель (в зависимости от размера белка) и подвергали электрофорезу в течение 90 мин при 100 В. Затем белок переносили на нитроцеллюлозные мембраны (1 ч, 100 В). После блокирования обезжиренным сухим молоком в течение 1 часа мембраны инкубировали в течение ночи с моноклональными антителами, направленными против следующих белков клеточного цикла, которые все были от BD Biosciences: cdk1 (IgG1, клон 1, разведение 1:2500; #610038), cdk2 (IgG2a, клон 55, разведение 1:2500; #610146), cdk4 (IgG1, клон 97, разведение 1:250; #610148), циклин A (IgG1, клон 25, разведение 1:250; #611269), циклин B (IgG1, клон 18, разведение 1:1000; #610220), циклин D1 (IgG1, клон G124-326, разведение 1:250; #554181), циклин D3 (IgG2b, клон 1, разведение 1:1000; #610280), p19 (IgG1, клон 52/p19, разведение 1:5000; #610530), p27 (IgG1, клон 57, разведение 1:500; #610244). Конъюгированные с HRP козьи антимышиные IgG (разведение 1:5000; #12-349; Merck Millipore, Темекула, Калифорния, США) служили в качестве вторичных антител. Мембраны ненадолго инкубировали с реагентом для обнаружения ECL (ECL™; Amersham/GE Healthcare, Мюнхен, Германия) для визуализации белков, а затем анализировали с помощью системы Fusion FX7 (Peqlab, Эрланген, Германия). В качестве внутреннего контроля служил β-актин (разведение 1:1000; #A5441; Sigma, Тауфенкирхен, Германия).
Поверхностная экспрессия E- и N-кадгерина
Опухолевые клетки промывали в блокирующем растворе (PBS, 0,5% BSA), а затем инкубировали в течение 60 мин при 4°C с моноклональными антителами (mAB), конъюгированными с фикоэритрином (PE), направленными против следующих антител: анти-человеческий E-кадгерин-PE (мышиный IgG2b, клон 180224; #FAB18381P) и анти-человеческий N-кадгерин-PE (крысиный IgG2a, клон 401408; #IC1388P) (оба от R&D Systems, Висбаден, Германия). Затем поверхностную экспрессию E- и N-кадгерина клеток RCC измеряли с помощью проточной цитометрии с использованием FACscan [анализ гистограммы канала FL-2H (log); 1×10 4 клеток/сканирование; BD Biosciences] и выражали в виде средних единиц флуоресценции. В качестве изотипического контроля служили крысиный IgG2a-PE (клон RG7/1.30; № 558067) или мышиный IgG2b-PE (клон 27-35; № 555743) (оба от BD Biosciences).
Блокировка экспериментов
Чтобы определить, влияют ли cdk1 и циклин B на рост опухолевых клеток в клеточных линиях Caki-1, KTC-26 и A498, клетки были трансфицированы. Опухолевые клетки (3×10 5 /6-луночные) были трансфицированы малой интерферирующей РНК (siRNA), направленной против cdk1 (Hs_CDC2_10, идентификатор гена: 983, целевая последовательность: AAGGGGTTCCTAGTACTGCAA) или циклина B (Hs_CCNB1_6, идентификатор гена: 891, целевая последовательность: AATGTAGTCATGGTAAATCAA) (оба от Qiagen, Хильден, Германия), с реагентом siRNA/трансфекции (реагент трансфекции HiPerFect; Qiagen) в соотношении 1:6. Необработанные клетки и клетки, обработанные 5 нМ контрольной siRNA (AllStars Negative Control siRNA; Qiagen), служили в качестве контролей. Затем рост опухолевых клеток определяли, как указано выше.
Статистический анализ
Все эксперименты проводились 3–6 раз. Статистическая значимость определялась с помощью U-критерия Вилкоксона-Манна-Уитни. Значение p < 0,05 считалось указывающим на статистически значимую разницу.
Результаты
Рост и пролиферация опухолевых клеток блокируются амигдалином
Воздействие амигдалина (10 мг/мл) в течение 24 ч или 2 недель привело к значительной и схожей степени ингибирования роста в течение 72 ч во всех трех линиях клеток почечно-клеточного рака, Caki-1, KTC-26 и A498, по сравнению с необработанными контрольными клетками ( рис. 1 ). Пролиферация клеток Caki-1, KTC-26 и A498 также была значительно снижена после 24 ч или 2 недель воздействия амигдалина по сравнению с контрольными клетками ( рис. 2 ). Противоопухолевые эффекты в клетках почечно-клеточного рака были сопоставимы после 24 ч и 2 недель лечения амигдалином ( рис. 2 ).
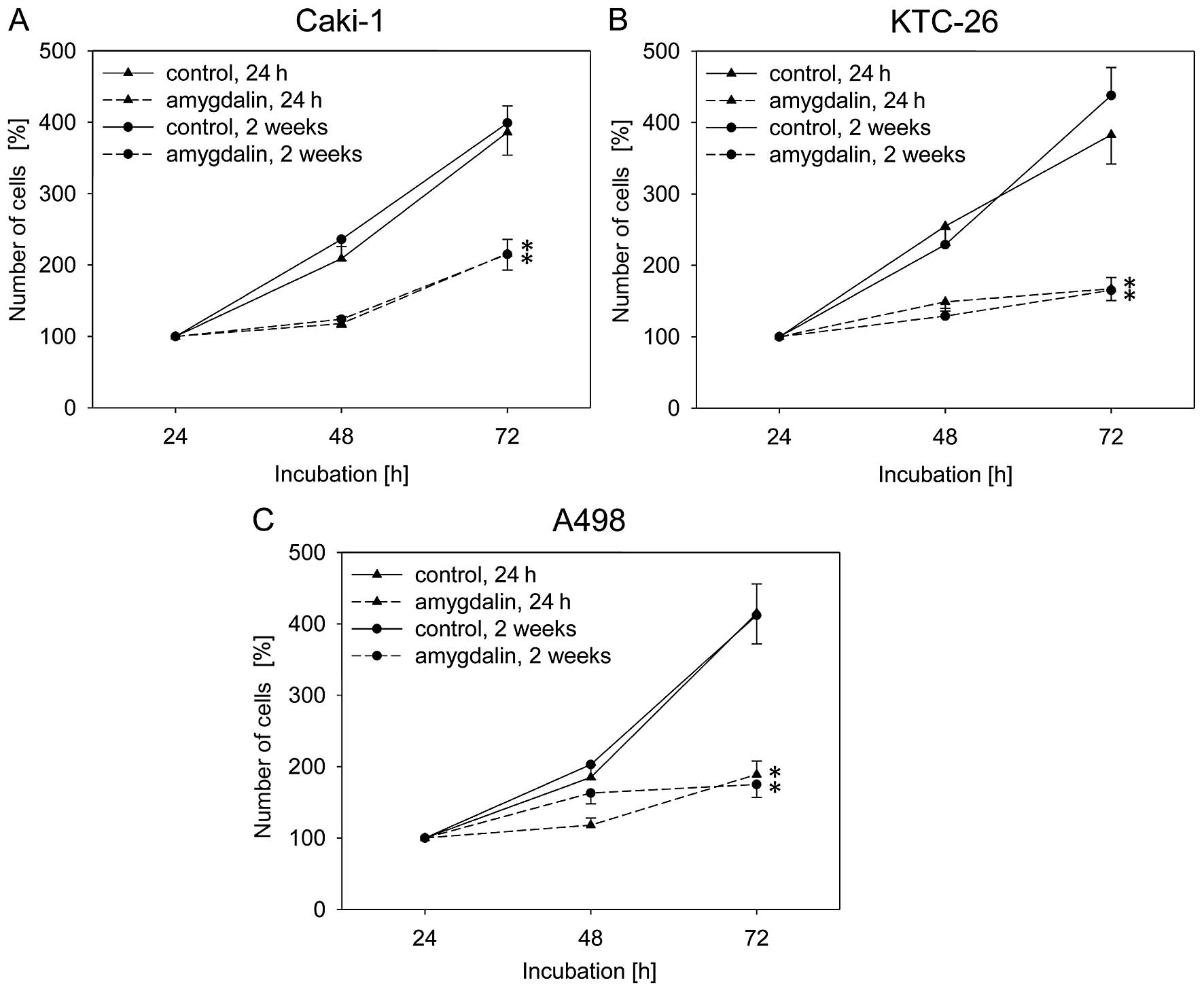 |
Рисунок 1Рост клеток почечно-клеточной карциномы (RCC), (A) Caki-1, (B) KTC-26 и (C) A498. Клетки обрабатывали 10 мг/мл амигдалина в течение 24 ч или 2 недель. Контрольные клетки оставались необработанными. Количество клеток было установлено на уровне 100% после 24 ч инкубации. Полоски указывают на среднее значение ± стандартное отклонение (SD). *p≤0,05 указывает на значительное отличие от контроля. n=5 экспериментов. |
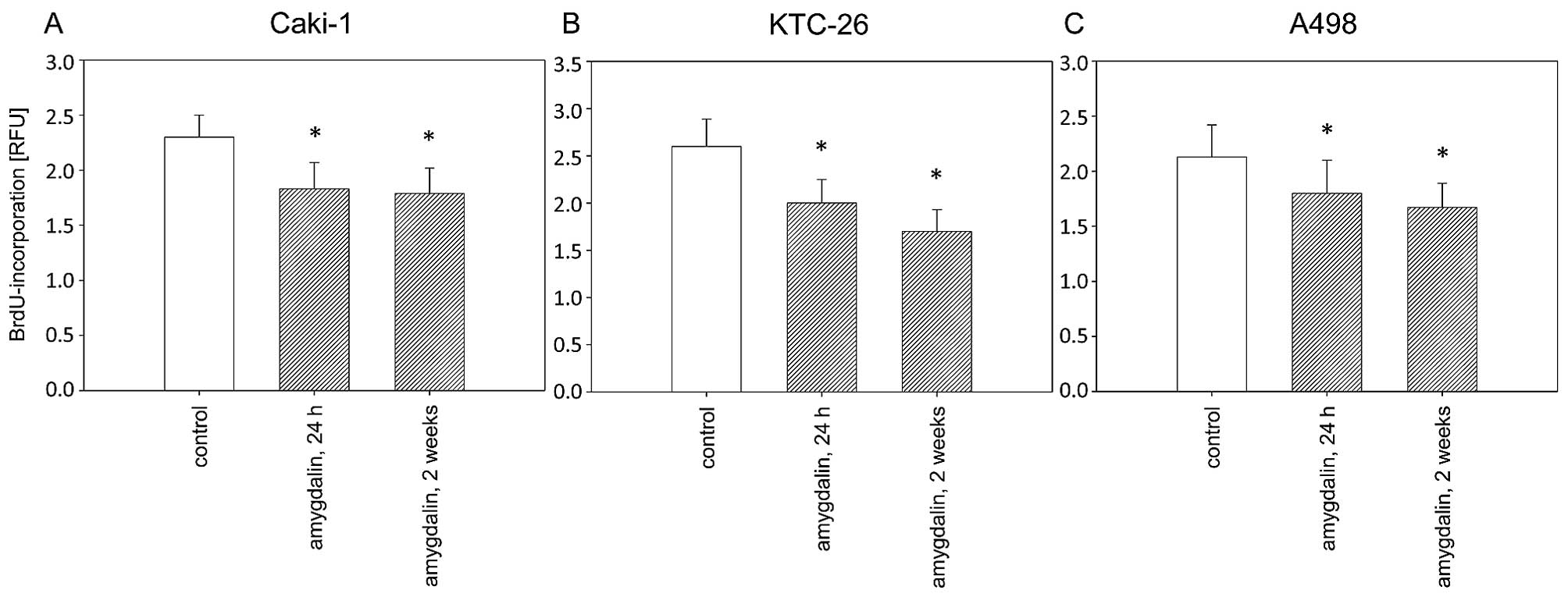 |
Рисунок 2Пролиферация клеток почечно-клеточной карциномы (RCC). Клетки (A) Caki-1, (B) KTC-26 и (C) A498 обрабатывали 10 мг/мл амигдалина в течение 24 ч или 2 недель. Контрольные группы оставались без обработки. Полоски указывают средние значения ± стандартное отклонение (SD). *p≤0,05 указывает на значимое отличие от контроля. n=5 экспериментов. |
Ни апоптоз, ни некроз не индуцируются амигдалином.
После введения амигдалина не было выявлено ни значительного раннего или позднего апоптоза, ни индукции некроза (данные не представлены).
Амигдалин изменяет процент клеток почечно-клеточного рака в фазах G0/1, S и G2/M
Амигдалин значительно увеличил процент клеток Caki-1 и A498 в фазе G0/G1 и уменьшил количество клеток в фазе S и G2/M через 24 ч и 2 недели ( рис. 3 ) воздействия по сравнению с необработанными контролями. В клетках KTC-26 амигдалин вызвал значительное снижение процента клеток в фазе G2/M, в то время как клетки в фазе S увеличились (24 ч, <2 недель). Не было измерено значительного увеличения процента клеток в фазе G0/G1 после 24-часовой обработки амигдалином в клетках KTC-26. Через 2 недели обработки амидалином в клетках KTC-26, сопровождавшейся увеличением S-фазы, количество клеток в фазе G0/G1 значительно снизилось ( рис. 3 ) по сравнению с контролем.
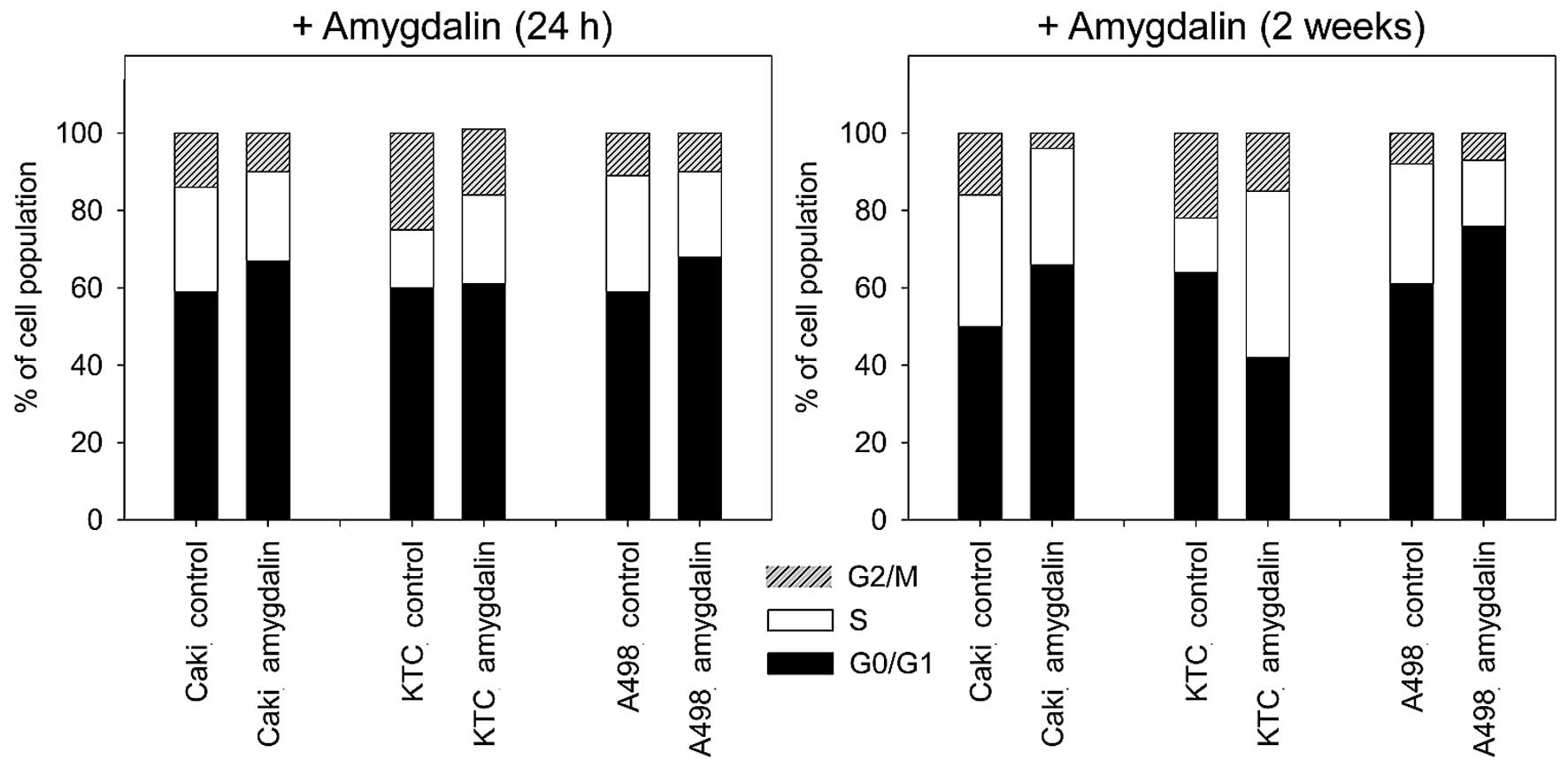 |
Рисунок 3Влияние амигдалина на распределение клеток почечно-клеточной карциномы (ПКР) в различных фазах клеточного цикла. Указан процент клеток Caki-1 (Caki), KTC-26 (KTC) и A498 в фазах G01/1, S и G2/M. Клетки ПКР, обработанные амигдалином в течение 24 ч или 2 недель, сравнивались с необработанными контрольными клетками. Показан один представитель из трех отдельных экспериментов. |
Амигдалин вызывает снижение экспрессии белка, активирующего клеточный цикл
Мы отметили, что изменения в прогрессии клеточного цикла сопровождались модуляцией белков, регулирующих клеточный цикл ( рис. 4 ). Во всех трех клеточных линиях, Caki-1, KTC-26 и A498, обработка амигдалином в течение 24 ч и 2 недель способствовала снижению регуляции активирующих клеточный цикл белков cdk1, cdk2 и cdk4, а также циклинов A и B, причем самые сильные эффекты были отмечены в отношении экспрессии cdk1 и циклина B. Циклин D1 также был снижен в Caki-1 и KTC-26 через 24 ч ( рис. 4 , левая панель) и в Caki-1 и A498 после 2 недель применения амигдалина ( рис. 4 , правая панель). Не было обнаружено выраженных изменений для циклина D3 ни в одной клеточной линии. В отличие от белков, активирующих клеточный цикл, экспрессия белка p19, ингибирующего клеточный цикл, была усилена после воздействия амигдалина в клеточных линиях Caki-1 (24 ч и 2 недели) и A498 (24 ч). p27 также был повышен в клетках A498 (24 ч) ( рис. 4 , левая панель). Однако p19 и p27 были снижены в клетках KTC-26, а снижение p27 было отмечено в клетках Caki-1 через 24 ч.
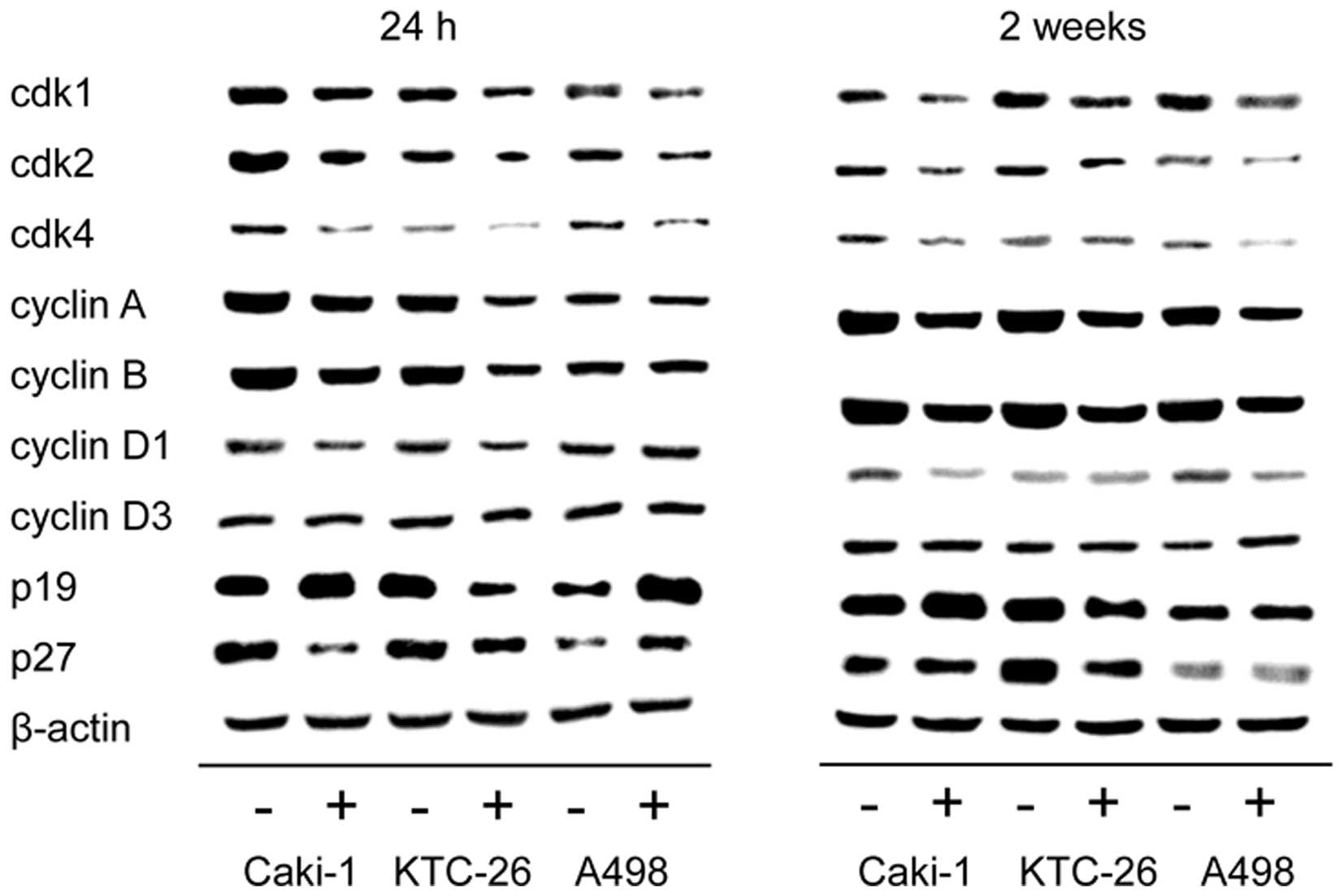 |
Рисунок 4Профиль экспрессии белков, регулирующих клеточный цикл, в клетках почечно-клеточной карциномы (RCC). Клетки Caki-1, KTC-26 и A498 после 24 ч (левая панель) или 2 недель (правая панель) воздействия амигдалина и необработанные контроли. −, контроль; +, амигдалин. β-актин служил внутренним контролем. Показан один представитель из трех отдельных экспериментов. |
Снижение уровня cdk1 и циклина B связано с ингибированием роста, вызванным амигдалином.
В связи с тем, что в настоящем исследовании наиболее яркое ингибирующее действие амигдалина было отмечено в отношении экспрессии cdk1 и циклина B, влияние этих двух белков на рост опухолевых клеток оценивалось путем блокирования их функции с помощью siRNA. Нокдаун cdk1 и циклина B привел к значительному ингибированию роста клеток во всех трех клеточных линиях по сравнению с необработанным и имитированным контролем ( рис. 5A–C ). Во всех трех клеточных линиях RCC блокирование экспрессии белков cdk1 и циклина B было подтверждено с помощью вестерн-блоттинга ( рис. 5D ).
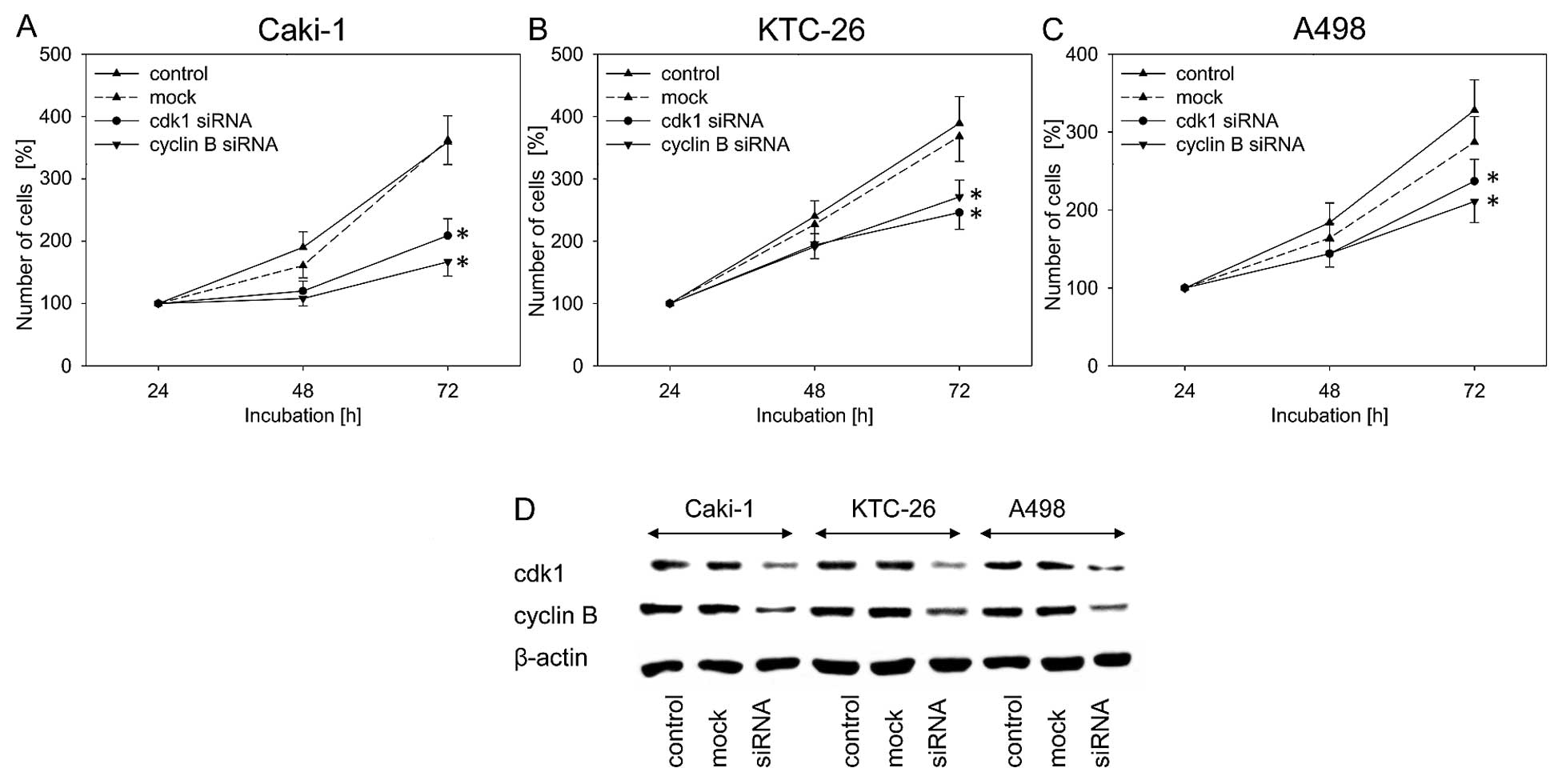 |
Рисунок 5Рост опухолевых клеток почечно-клеточного рака (RCC). (A) Caki-1, (B) KTC-26 и (C) A498 после функциональной блокировки с помощью siRNA, нацеленной на cdk1 и циклин B. AllStars отрицательный контроль siRNA служил в качестве контроля трансфекции (макет). Контроли оставались необработанными. Полоски указывают стандартное отклонение (SD). * p≤0,05, значимое различие с контролем. n=5 экспериментов. (D) Профиль экспрессии белка регулирующих клеточный цикл белков клеток Caki-1, KTC-26 и A498 после функциональной блокировки с помощью siRNA, нацеленной на cdk1 и циклин B. AllStars отрицательный контроль siRNA служил в качестве контроля трансфекции (макет). Контроли оставались необработанными. β-актин служил в качестве внутреннего контроля. Показан один представитель из трех отдельных экспериментов. |
Маркеры дифференциации модулируются обработкой амигдалином
Дедифференцировка опухолевых клеток сопровождается потерей E-кадгерина и повышенной экспрессией N-кадгерина. Экспрессия этих двух маркеров дифференцировки была определена для того, чтобы оценить, влияет ли амигдалин на дифференцировку опухолевых клеток. После 24 ч обработки амигдалином мы отметили значительное снижение поверхностного N-кадгерина в трех клеточных линиях ( рис. 6 ). После 2 недель обработки амигдалином было отмечено заметное увеличение экспрессии E-кадгерина на поверхности клеток Caki-1 и KTC-26 ( рис. 6A и B ). В клетках KTC-26 повышение E-кадгерина было связано со значительным снижением поверхностного N-кадгерина ( рис. 6B ). Однако экспрессия N-кадгерина в клетках Caki-1 значительно увеличилась после 2 недель воздействия амигдалина, хотя MFU все еще была ниже, чем для E-кадгерина ( рис. 6A ). Никакого существенного влияния на Е-кадгерин в клетках А498 после 2 недель применения амигдалина отмечено не было.
 |
Рисунок 6Поверхностная экспрессия маркеров дифференциации E- и N-кадгерина на клетках почечно-клеточной карциномы (RCC). (A) Клетки Caki-1, (B) KTC-26 и (C) Клетки A498 через 24 часа и 2 недели применения амигдалина. Поверхностная экспрессия указана как средние относительные единицы флуоресценции [MFU (%)]. Контрольные значения были установлены на уровне 100% (пунктирная линия). Полоски указывают средние значения ± стандартное отклонение (SD). *p≤0,05 указывает на значимое отличие от контроля. n=5 экспериментов. |
Обсуждение
В настоящем исследовании мы отметили, что обработка линий клеток почечно-клеточного рака Caki-1, KTC-26 и A498 амигдалином вызвала значительное ингибирование роста и пролиферации клеток. Подобное снижение роста после применения амигдалина было отмечено в клетках немелкоклеточного рака легких ( 19 ) и рака мочевого пузыря ( 18 ) in vitro , а также в клетках рака шейки матки in vivo ( 20 ). На основании наших данных мы приходим к выводу, что ингибирование роста, вызванное амигдалином, не связано с апоптозом или некрозом. Другие раковые клетки, такие как клетки рака шейки матки, мочевого пузыря и простаты, реагируют на амигдалин апоптозом, что приводит к ингибированию роста ( 18 , 20 , 21 ). Таким образом, способ действия амигдалина, по-видимому, зависит от типа рака.
Хотя ингибирование роста во всех трех линиях клеток RCC сопровождалось изменениями в процентном содержании клеток в различных фазах клеточного цикла, изменения не были однородными. Обработка клеток Caki-1 и A498 амигдалином вызвала увеличение клеток в фазе G0/G1 за счет снижения S- (Caki-1 и A498) и G2/M-фаз (Caki-1). Обработка амигдалином вызвала увеличение клеток в фазе S в клетках KTC-26, в то время как фазы G2/M и G0/G1 были снижены через 2 недели. Повышение количества клеток в фазе S в KTC-26 после применения амигдалина, вероятно, свидетельствует об остановке клеточного цикла в S-фазе. В различных линиях клеток рака мочевого пузыря также была отмечена блокада роста, вызванная амигдалином, которая осуществлялась путем различного влияния на прогрессирование клеточного цикла, увеличивая процент клеток в фазе G0/G1 в одной линии клеток и повышая количество клеток в фазе S в другой ( 18 ).
Изменение процентного содержания фаз клеточного цикла коррелировало с модуляцией экспрессии белков, регулирующих клеточный цикл. Во всех трех линиях клеток RCC большинство белков, активирующих клеточный цикл, были снижены после лечения амигдалином, в частности cdk1 и циклин B. Известно, что Cdk1 является ключевой киназой для митотического входа ( 22 ). Было показано, что ось cdk1-циклин B в опухолевых клетках участвует в продвижении митоза и преодолении остановки клеточного цикла, зависящей от химиотерапии ( 23 ). Во всех трех линиях клеток RCC снижение cdk1 и циклина B было связано с ингибирующим эффектом, оказываемым амигдалином, что доказано с помощью нокдауна siRNA. Наряду с осью cdk1-циклин B, ось cdk2-циклин A также была отчетливо изменена в клетках RCC. Cdk2/циклин A способствует переходу из фазы G1 в фазу S и, как было показано, важен для ингибирования клеток рака мочевого пузыря, вызванного амигдалином ( 18 ). Мы предполагаем, что накопление клеток G0/G1 было обусловлено ингибирующим эффектом, который амигдалин оказывал на cdk2 и циклин B. Однако обработка клеточной линии KTC-26 амигдалином не привела к остановке фазы G0/G1, а скорее к остановке фазы S. Предположительно, это связано с ингибирующим клеточный цикл белком p19, уровень которого был повышен в клетках Caki-1 и A498 после применения амигдалина, но снижен в клетках KTC-26. p19 участвует в активности контрольной точки G1, останавливая вход клеток в фазу S ( 24 ). Ингибирование p19 увеличивает фракцию клеток в фазе S ( 25 ). Таким образом, это, вероятно, объясняет, почему мы отметили увеличение в фазе G0/G1 клеток Caki-1 и A498, в то время как клетки KTC-26 накапливались в фазе S. Следовательно, мы предполагаем, что вызванные амигдалином изменения в экспрессии регулирующего клеточный цикл белка ответственны за различные эффекты на прогрессирование клеточного цикла в разных клеточных линиях.
Во время возникновения и прогрессирования опухоли RCC происходит дедифференциация, сопровождаемая эпителиально-мезенхимальным переходом (EMT) ( 26 , 27 ). Во время перехода опухолевые клетки теряют эпителиальный (E)-кадгерин и приобретают нейральный (N)-кадгерин ( 26 , 28 ). Во всех трех линиях клеток RCC, использованных в этом исследовании, применение амигдалина в течение 24 часов вызвало значительное снижение экспрессии N-кадгерина, что указывает на повторную дифференциацию. Ранее N-кадгерин был связан с агрессивностью и злокачественным потенциалом RCC ( 29 ). Следовательно, мы предполагаем, что нарушение экспрессии N-кадгерина при 24-часовом применении амигдалина приводит к менее злокачественному типу опухоли. После 2 недель воздействия амигдалина стало очевидным переключение способа действия амигдалина, в основном затрагивающее экспрессию E-кадгерина. Экспрессия поверхности E-кадгерина Caki-1 и KTC-26 значительно увеличилась. В различных клетках RCC in vitro эпителиально-мезенхимальный переход, рост опухоли и агрессивный фенотип, как было показано, обратно связаны с низким уровнем E-кадгерина ( 30 , 31 ). Плохой прогноз и опухоли RCC высокой степени злокачественности были связаны с недостатком E-кадгерина ( 32 ). В опухолевой ткани RCC человека наблюдалось 3-кратное снижение E-кадгерина ( 33 ), и было постулировано, что экспрессия E-кадгерина в RCC является важным предиктором рецидива заболевания ( 34 ). Таким образом, мы предполагаем, что вызванное амигдалином увеличение E-кадгерина в клетках Caki-1 и KTC-26, которое мы отметили, указывает на повторную дифференцировку обратно к менее агрессивному фенотипу. Наблюдаемое переключение от снижения N-кадгерина к усилению E-кадгерина указывает на различные режимы действия амигдалина. Поскольку уровень N-кадгерина больше не снижался ни в одной из трех линий клеток после 2 недель воздействия амигдалина и даже повышался в клетках Caki-1, мы предполагаем, что соотношение между экспрессией E- и N-кадгерина имеет решающее значение для статуса дифференциации. Действительно, было показано, что эффект N-кадгерина зависит от экспрессии E-кадгерина ( 29 ).
В заключение, амигдалин ингибирует прогрессирование клеточного цикла и рост опухолевых клеток в клетках почечно-клеточного рака, по крайней мере частично, за счет нарушения экспрессии cdk1 и циклина B, тем самым оказывая противоопухолевое действие in vitro . Хотя in vitro не было обнаружено некротических эффектов , возможны токсические эффекты, вызванные деградацией амигдалина до HCN, и этот аспект требует оценки. Необходимы дальнейшие исследования с использованием животных для проверки эффектов амигдалина in vitro и оценки того, вызывает ли HCN цитотоксичность in vivo .
Благодарности
Это исследование было поддержано «Стифтунгом Бригитты и Норберта Мут» и «Проф. Доктор Фонд Карла и Герхарда Шиллеров
Антиноцицептивный эффект амигдалина, выделенного из Prunus armeniaca, на боль, вызванную формалином у крыс
Антиноцицептивный эффект амигдалина,
выделенного из Prunus armeniaca, на боль, вызванную формалином у крыс
оригинал статьи:
Аннотация
Амигдалин — растительный глюкозид, выделенный из косточек розоцветных плодов, таких как абрикосы, персики, миндаль, вишня и слива. Чтобы исследовать обезболивающую активность амигдалина, мы вызывали боль у крыс посредством интраплантарной инъекции формалина и оценивали антиноцицептивный эффект амигдалина в дозах 0,1, 0,5, 1,0 и 10,0 мг/кг веса тела, наблюдая за ноцицептивным поведением, таким как облизывание, кусание и встряхивание, числом Fos-иммунореактивных нейронов в спинном мозге и экспрессией мРНК воспалительных цитокинов в коже подошвы. Внутримышечная инъекция амигдалина значительно уменьшала тоническую боль, вызванную формалином, как в ранней (первые 10 мин после инъекции формалина), так и в поздней фазе (через 10–30 мин после первоначальной инъекции формалина). В поздней фазе амигдалин действительно уменьшал вызванную формалином боль дозозависимым образом в диапазоне доз менее 1 мг/кг. Молекулярный анализ, нацеленный на c-Fos и воспалительные цитокины, такие как фактор некроза опухоли-альфа (ФНО-альфа) и интерлейкин-1 бета (ИЛ-1бета), также показал значительный эффект амигдалина, который соответствовал результатам поведенческого анализа боли. Эти результаты свидетельствуют о том, что амигдалин эффективен для облегчения воспалительной боли и что его можно использовать в качестве анальгетика с антиноцицептивной и противовоспалительной активностью.
Терапевтические эффекты и токсичность амигдалина
Терапевтические эффекты и токсичность амигдалина
Информация о статье
Ияну Одуволе 1 , Абдельнасер А 2*
1 Программа по биотехнологии, Школа наук и инженерии, Американский университет в Каире, Каир, Египет 2 Институт глобального здоровья и экологии человека, Школа наук и инженерии, Американский университет в Каире, Каир, Египет
* Автор-корреспондент: Абдельнасер А., Институт глобального здоровья и экологии человека, Школа наук и инженерии, Американский университет в Каире, почтовый ящик: 74, Новый Каир, Египет
Получено: 25 января 2020 г.; Принято: 13 марта 2020 г.; Опубликовано: 15 мая 2020 г.
Цитата:
Ияну Одуволе, Абдельнасер А. Терапевтические эффекты и токсичность амигдалина. Журнал биотехнологии и биомедицины 3 (2020): 039-049.
Абстрактный
Амигдалин — это цианидный гликозид, который естественным образом присутствует во многих фруктах, в основном в горьком миндале, персиках и в химическом виде как лаэтрил. Он вызвал много перекрестных разговоров среди исследователей, особенно по поводу его противоракового потенциала и связанной с ним токсичности цианида. Довольно много отчетов продемонстрировали его химиотерапевтическое действие на различные типы раковых клеток in vitro и очень мало in vivo. Однако его давние несколько клинических неудач и токсичность цианида при различной дозировке сделали его в целом неприемлемым. Однако амигдалин, принимаемый в правильной дозировке перорально, может не привести к токсичности, но это еще не было количественно определено, и на него часто влияет активность микробного содержимого кишечника. Его фармакологическая активность была тщательно изучена, но его противоопухолевая активность все еще неубедительна. Новые клинические исследования с новыми научными подходами могут попытаться дать удовлетворительные ответы о его противоопухолевых эффектах. В этом обзоре обсуждаются метаболизм, различные фармакологические активности, токсичность и современное понимание противоопухолевого эффекта амигдалина.
Ключевые слова
Амигдалин, Токсичность цианида, Противоопухолевый, Метаболизм
Подробности статьи
1. Введение
Амигдалин был впервые выделен в 1830-х годах из горького миндаля Робике и Бутрон-Шарларом, а позднее было обнаружено, что он встречается в природе как цианогенный гликозид в плодах и семенах абрикосов, персиков и горького миндаля [1, 2]. Ферментативный гидролиз амигдалина дает бензальдегид и синильную кислоту, в то время как его кислотный гидролиз дает единственный продукт — гентибиозу. Амигдалин также демонстрирует прегепатический метаболизм, производящий пруназин в кишечнике [3]. Предметом споров был вопрос, вызывает ли амигдалин регрессию опухоли или он токсичен при правильно введенной дозе, что делает его токсичным химикатом, а не терапевтическим препаратом. Многие эксперименты in vitro продемонстрировали, что он способен вызывать апоптотическую гибель клеток и вызывать остановку клеточного цикла или задерживать его прогрессирование в нескольких линиях раковых клеток [4, 5]. В нескольких экспериментах in vivo по изучению противоопухолевых эффектов амигдалина сообщалось о снижении роста ксенотрансплантатов клеток Hela in vivo у голых мышей [4].
Однако амигдалин подвергся критике как терапевтическое средство со стороны многих авторов из-за его многочисленных, постоянных неудач в клинических испытаниях [6]. Лаэтрил, химически модифицированная форма амигдалина, которая, как сообщалось ранее, работала, также не удалась во многих клинических испытаниях, но было высказано предположение, что между ними может быть разница [7]. Исследования, проведенные для оценки токсичности амигдалина, выявили его токсичность, особенно при пероральном приеме, и это привело к его запрету FDA в 1979 году [2]. Более того, семейство анаэробных бактерий, обитающих в кишечнике, способно выделять цианид в кишечнике при распаде амигдалина [2, 8]. Однако роданеза, которая является вездесущим ферментом, обнаруженным в митохондриях многих организмов, способна преобразовывать высокое содержание цианида, образующегося из амигдалина, в безвредный тиоцианат [7]. Амигдалин обладает широким спектром фармакологической активности, включая анальгетическое и противоастматическое действие. В этом обзоре мы рассмотрим противораковое действие и токсичность амигдалина.
2. Метаболизм амигдалина
Первый полный ферментативный и кислотный гидролиз амигдалина был описан Хайсманом и Найтом в 1967 году. Когда амигдалин подвергается воздействию β-глюкозидазы, он дает глюкозу и пурназин. Пурназин далее гидролизуется с образованием глюкозы и другого соединения, называемого мандельнотирилом. Продукт неферментативно превращается в бензальдегид и синильную кислоту. Кислотный гидролиз амигдалина дает единственный продукт — гентибиозу (дисахарид с β-1-6 связью). Кинетику Михаэлиса-Ментен можно использовать для определения стадий вовлеченного ферментативного действия. Были идентифицированы три фермента, которые катализируют на трех различных стадиях, и они включают: амилазу лиазу, пруназин лиазу и гидроксиллиазу. Кроме того, ферменты можно дополнительно очистить с помощью тонкослойной хроматографии [1, 9]. Синильная кислота и глюкозидаза являются двумя основными ключевыми участниками, необходимыми для амигдалина, чтобы вызывать апоптоз и подавлять пролиферацию раковых клеток [7]. Кроме того, производительность глюкозидазы значительно улучшается в присутствии лактата, выделяемого во время анаэробного дыхания раковыми клетками [2]. HCN также способен разрушать раковые клетки, увеличивая кислотное содержание клетки и заставляя лизосому высвобождать свое ферментативное содержимое, тем самым приводя к лизису клеток [7]. Амигдалин был обнаружен в кровотоке крыс сразу после 5 минут введения [10]. Фармакокинетическое исследование амигдалина показало, что амигдалин может проходить два различных метаболических пути [3]. Первый - это прегепатический или первичный метаболизм амигдалина в пруназин в проксимальной части кишечника, а второй путь включает прямой метаболизм в цианид и бензальдегид бактериальным кишечником, которые представляют собой основную токсичность цианида.
Метаболизм перорально вводимого амигдалина в условиях имитированной желудочно-кишечной клеточной культуры показал, что он сначала расщеплялся до пруназина, а затем до минделонитрила под действием β-глюкозидазы, после чего гидроксилировался до гидроксиминделонитрила в тонком кишечнике [11]. На этой фазе не образовывалось ни цианида, ни бензальдегида, и это указывает на то, что цианид, вероятно, образуется в нижнем отделе кишечника, который богат микрофлорой [11]. Концентрацию амигдалина в плазме можно определить методом жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) [10].
3. Фармакологическая активность амигдалина
3.1 Противоастматическое действие
Амигдалин служит для облегчения астмы из-за его разложения, которое производит синильную кислоту, которая может расслаблять дыхательные движения, в определенной степени угнетая дыхательный центр. Также было замечено, что он усиливает синтез легочного сурфактанта в экспериментальной модели животных, страдающих синдромом респираторного заболевания [12, 13]. Сообщалось, что амигдалин защищает альвеолярные эпителиальные клетки II типа (AECIIs), выделенные из легких недоношенных крыс, которые были помещены в условия гипероксии. Это состояние ингибировало пролиферацию AECII и снижало уровни мРНК легочного сурфактанта в AEC II in vitro, тем самым вызывая повреждение легких у недоношенных крыс. Амигдалин в концентрации 200 микромоль/л работал лучше всего, стимулируя пролиферацию AECII недоношенных крыс и повышая уровни мРНК SP [14]. Кроме того, Semen Armeniacae Amarum (SAA), содержащий амигдалин в качестве активного ингредиента, также оказывает противоастматическое действие на мышиную модель аллергической астмы посредством индукции OVA [12]. Было сказано, что SAA снижает уровень интерлейкина (IL)-4 и подавляет активность хелперных Т-клеток 2-го типа (Th2). Гиперреактивность дыхательных путей (AHR) и воспаление дыхательных путей, проявляющиеся при астматических эффектах, были снижены, что может быть связано с изменением ответа Th2 на аллерген.
3.2 Анальгезирующий эффект
Анальгезирующая и противовоспалительная активность амигдалина ранее была протестирована с помощью in vitro липополисахаридной (ЛПС)-индуцированной клеточной линии и крысиной модели с артритом голеностопного сустава, вызванным каррагинаном [15]. Амигдалин, который был извлечен из семян розоцветных косточковых плодов, подавлял уровень экспрессии важных молекулярных маркеров боли и воспаления, включая фактор некроза-α (ФНО-α) и интерлейкин-1β (ИЛ-1β), и уменьшал гипералгезию артритного голеностопного сустава в концентрации 0,0005 мг/кг. Было также продемонстрировано, что амигдалин, извлеченный из Prunus armeniaca, может облегчить боль, вызванную формалином, у крыс, когда уровень дозировки составляет менее 1 мг/кг, что также может быть связано с влиянием на экспрессию воспалительных цитокинов, таких как фактор некроза опухоли-α (TNF-α) и интерлейкин-1β (IL-1β) [13]. Кроме того, он также снижал экспрессию циклооксигеназы (COX)-2, индуцируемой синтазы оксида азота (iNOS), что, следовательно, снижало уровни простагландинов E2 и оксида азота, тем самым вызывая противовоспалительный и анальгезирующий эффект [16]. Тот же эффект был также зарегистрирован в тесте с горячей пластиной и индуцированными уксусом извиваниями, где мыши, которым вводили амигдалин, не демонстрировали никакой реакции прыжка или характерной для морфина реакции поднятия хвоста [17].
3.3 Повышение иммунной системы организма
Амигдалин оказывает антиатеросклеротическое действие, подавляя противовоспалительную реакцию посредством стимуляции иммуномодулирующего эффекта регуляторных Т-клеток (Tregs), что в результате приводит к потере атеросклеротической бляшки, а также к увеличению площади просвета [18]. Также сообщалось, что он стимулирует периферические лимфоциты крови, стимулированные полигидроксиалканоатом PHA, секретирует IL-2 и IFN-γ, тем самым помогая иммунной функции [13]. Пептид T (PT) октапептид, который часто называют аналогом амигдалина из-за схожих пептидомиметиков, как было показано, эффективен при лечении псориаза [19]. Было показано, что PT стимулирует повышенную экспрессию TGF-β, HSP70 и α-v интегрина, а также снижение ICAM-1 в клетках кератиноцитов человека [19]. Кроме того, было показано, что три аналога, полученные из амигдалина, имеющие пептидомиметики и не имеющие цианидной группы, имеют такое же биологическое поведение, как ПТ [19]. Они оказывают такое же иммуномодулирующее действие на клетки кератиноцитов человека, что предполагает их использование при лечении псориаза.
3.4 Влияние амигдалина на пищеварительную систему
Расщепление амигдалина в пищеварительных жидкостях человека и абсорбция его метаболитов в тонком кишечнике в условиях стимулированного пищеварения в ЖКТ и кишечной культуры человека показали влияние амигдалина на стенку кишечника и риск, связанный с его приемом с пищей [11]. Бензальдегид, полученный из амигдалина, может ингибировать активность пепсина и, следовательно, влиять на пищеварительную функцию [13]. Было показано, что введение пепсина крысе, обработанной CCl4, в дозе 500 мг/кг ингибировало уровень АСТ, АЛТ и увеличивало время эуглобулинового лизиса. Кроме того, соединительные ткани печени крысы пролиферируют меньше в присутствии гидролизата пепсина миндальной воды, но пролиферация не была затронута после индукции крыс D-галактозамином из-за восстановленного уровня АСТ и АЛТ [13]. Сообщалось также, что амигдалин оказывает терапевтическое действие на хронический гастрит и хронический атрофический гастрит у крыс [11, 13].
3.5 Антиангиогенный эффект
Сообщалось, что амигдалин подавляет ангиогенез в эндотелиальных клетках диабетических крыс, вызванных стрептозотоцином, за счет снижения количества созревших микротрубочек в аортальном кольце диабетических крыс, леченных амигдалином [20]. Аортальное кольцо крысы без лечения амигдалином мигрировало и пролиферировало после 7 дней инкубации, как было выявлено с помощью оптической микроскопии. Также было высказано предположение, что антиангиогенный эффект амигдалина может также играть роль в его активности подавления опухолей [20].
4. Токсичность цианида амигдалина
Бензальдегид, который отвечает за аромат и вкус фруктов, может быть гидролизован до бензойной кислоты и синильной кислоты (HCN). Последняя в основном ответственна за токсичность, когда амигдалин попадает внутрь или другими путями. Процесс включает ингибирование цитохромоксидазы, которая, в свою очередь, влияет на цепь переноса электронов и митохондрии [2]. Прием амигдалина в его естественной форме, которая является цианогенным гликозидом, может легко привести к токсичности из-за действия бета-глюкозидазы в организме человека [2]. Было установлено, что 4 г амигдалина в день после перорального приема человеком достаточно, чтобы вызвать системную токсичность [13]. Цианид также обладает способностью снижать уровень АТФ в мозге и увеличивать образование лактата, нарушая цикл Кребса [21]. Было зарегистрировано несколько случаев токсичности амигдалина либо при потреблении его исходных фруктов, либо синтетического соединения лаэтрила. Только две из десяти мышей выжили, когда им внутривенно вводили 500 мг/кг амигдалина [13]. Токсичность у мышей могла быть результатом расщепления амигдалина до цианида под действием β-глюкозидазы кишечных микробов у мышей [22]. Исследование было проведено NCI, в котором было зафиксировано шесть случаев его токсичности, и это привело к окончательному запрету амигдалина в 1979 году FDA [2].
Однако несколько исследований показали, что амигдалин, вводимый другими способами, кроме перорального, может не приводить к токсичности. Одно из более ранних исследований показало, что токсичность цианида наблюдалась как у обычных, так и у стерильных крыс, когда амигдалин вводился перорально, но никакой токсичности не наблюдалось при введении парентерально [23]. Недавно сообщалось, что 4-летнему мальчику давали амигдалин без определенной дозировки внутривенно и перорально из абрикосовых косточек, и уровень цианида в сыворотке резко возрос, что привело к отравлению цианидом [1]. Основные симптомы отравления цианидом на ранней стадии включают легкое раздражение, беспокойство, сонливость и головокружение. На поздней стадии отравления цианидом могут наблюдаться судороги, гипотония и сердечно-сосудистый отек [21]. Более того, сообщалось, что высокая доза амигдалина может не вызывать высокой токсичности в организме [1]. Был описан случай пациента, который принял дозу, в два раза превышающую его обычную, но не проявил никаких признаков отравления цианидом. Токсичность цианида может варьироваться от человека к человеку и может зависеть от возраста, ожирения, дозировки, состояния питания и путей введения [2]. Многие из этих факторов влияют на популяцию микробного фермента, ответственного за деградацию амигдалина. Внутривенный путь приводит к меньшей токсичности цианида из-за активности роданезы и отсутствия активности β-глюкозидазы [24]. Роданеза (тиосульфатсульфотрансфераза) способна преобразовывать цианид, выделяемый из амигдалина, в безвредный тиоцианат с помощью тиосульфата, и его распределение в тканях зависит от уровня воздействия цианида на организм [7]. Многие исследования показывают, что роданеза присутствует в больших количествах в нормальной ткани, но отсутствует в раковых клетках [4].
Увеличение массы тела снижает количество бактериодет, но диета с высоким содержанием клетчатки увеличивает популяцию микробов в кишечнике [24]. Сообщалось, что витамин С ускоряет преобразование амигдалина в цианид in vitro и снижает уровень хранения цистеина, необходимого для процесса детоксикации [25]. Прием витамина B12 и серосодержащих аминокислот, таких как метионин и цистеин, также может влиять на детоксикацию цианида, поскольку они влияют на активность фермента роданезы [26]. Витамин B12 действует как хелаторы, связывается с цианокобаламином и способствует выведению цианида через почки. Он используется в качестве антидота цианида, поскольку помогает активировать процесс детоксикации роданезы [26]. Проведенное исследование показало, что гидроксокобаламин может эффективно снижать токсичность цианида, вызванную амигдалином. Крысы, которым вводили гидроксокобаламин после введения амигдалина в терапевтической дозе 20 мг/кг массы тела, показали значительное снижение концентрации лактата и цианида в сыворотке по сравнению с контролем [27]. Кроме того, гистологическое исследование печени не выявило морфологических изменений по сравнению с крысой без антидота. Также сообщалось, что гидроксокобаламин устраняет высокий объем упакованных эритроцитов (PCV) и сниженный pH крови, наблюдаемые у крыс после введения амигдалина. Некоторые крысы, которых кормили амигдалином без последующего приема гидроксокобаламина, не выжили в течение экспериментального периода из-за отравления цианидом, в то время как у крыс, которых кормили антидотами, не было зарегистрировано ни одной смерти. Многие специфические антидоты, включая нитрит, метгемоглобин и соединения кобальта, служат антагонистами цианида, и они использовались при лечении отравления цианидом [28]. Однако в основном применяется поддерживающее лечение, особенно когда признаки и симптомы не могут быть прослежены до истории болезни [28]. Как правило, тот же метод лечения отравления цианидом из других источников, таких как маниока и цианистые соединения, можно распространить и на отравление амигдалином.
5. Влияние кишечной микробной флоры на амигдалин
Метаболизм препарата или любого чужеродного соединения, поступающего в организм, зависит от ЖКТ, просвета, кишечника и кишечных микробов, особенно при приеме внутрь [2]. Firmicutes, Bacteriodetes и Actinobacteria являются основными группами бактерий, способствующими выделению цианида в кишечнике, и они в основном являются анаэробами [2]. Кишечник содержит множество ферментов, включая нуклеазы, липазы, трансферазы и пептидазы, а также ферменты микрофлоры [2]. Было показано, что кишечная β-глюкозидаза и микробная β-глюкозидаза работают на разных субстратах и дают разные продукты. β-глюкозидаза, которая является лактазефлоризингидролазой (LPH) и цитозольной β-глюкозидазой (CBG), обнаруженная в слизистой оболочке кишечника, расщепляет гликозидные связи и действует на другие соединения, такие как желчь и жирные кислоты, образуя канцерогены. Кишечная β-глюкозидаза также может преобразовывать амигдалин в пруназин, при этом синильная кислота не образуется [1].
Другая β-глюкозидаза из микробов, находящихся в кишечнике, в основном гидролизует амигдалин до HCN. Несколько исследований показали, что кишечные бактерии могут гидролизовать амигдалин до цианида, и это пропорционально количеству микробного содержимого кишечника [8]. Кроме того, токсичность, вызванная гидролизом амигдалина, была значительно снижена, когда рост кишечных микробов был подавлен у мышей, которым вводили 300 мг/кг, в то время как у нелеченых мышей токсичность вызывала токсичность и показывала уровень смертности на 60% выше [29, 30]. Было показано, что человеческий стул гидролизует около 50% амигдалина до цианида из-за избыточной присутствующей флоры по сравнению с таковой у мышей и обезьян [8]. Bacteriodetes в основном используются для производства глюкозидазы. Пребиотики и пробиотики влияют на бактериальную популяцию в кишечнике и регулируют ее [31]. Пребиотики — это биологические молекулы, в то время как пробиотики — это организмы, которые модулируют активность микробиоты кишечника на благо хозяина. Пребиотики способны связывать или поглощать канцерогены и снижать риск токсичности цианида от амигдалина. Было показано, что Lactobacillus и Bifidobacterium снижают активность β-глюкозидазы от Bacteriodetes [31].
6. Противораковая активность амигдалина
Считается, что амигдалин в изобилии содержится в семенах некоторых растений, включая абрикосы, яблоки, миндаль и персики, и это дает возможность протестировать его на многих раковых клетках. Чен и др. впервые сообщили о раке шейки матки, что амигдалин оказывает апоптотическое действие на линию клеток Hela рака шейки матки. Сообщалось, что обработанные амигдалином линии клеток Hela сначала окрашивались 4,6-диамино-2-фенилиндолом (DAPI), после чего обрабатывались аннексином V-FITC и пропидиум-йодидом соответственно. Действие антиапоптотических белков BcL-2 было снижено, а проапоптотических белков Bax — увеличено. Также наблюдалось увеличение активности каспазы и инициирование внутренних апоптотических путей. Было высказано предположение, что амигдалин оказывает терапевтическое действие на рак шейки матки за счет снижения жизнеспособности клеток Hela in vitro . Кроме того, тот же результат был также сообщен для ксенотрансплантата клеток Hela in vivo . Более того, ранее сообщалось о том, что эффект амигдалина, извлеченного из семени Armenlacae , принадлежащего к семейству пруназинов, был протестирован на клетках рака простаты DU 145 и LN CAT [32]. Было заявлено об увеличении ферментов каспазы 3 с понижением регуляции антиапоптотического белка BcL-2 и повышением регуляции белков Bax. Считается, что экстракт амигдалина вызвал апоптотическую гибель клеток рака простаты человека [32].
Химиопрофилактический потенциал амигдалина также был протестирован на клетках рака молочной железы in vitro . Сообщалось, что он вызывал цитотоксичность клеток MCF7, положительных по рецептору эстрогена (ER), MDA-MB-237 и клеток рака молочной железы Hs 578T с тройным отрицательным статусом (TNBC). Кроме того, те же действия были замечены с BcL-2, Bax и каспазами [33]. Кроме того, стимулировались митоген-активируемые протеинкиназы p38 (p38 MAPK), проапоптотическая сигнальная молекула, и дальнейшее лечение амигдалином также ингибировало адгезию клеток рака молочной железы Hs 578T. Было показано, что амигдалин может быть эффективен в отношении клеток рака молочной железы. Похожий случай адгезии также был зарегистрирован в клетках рака мочевого пузыря [5]. Отчетливое снижение адгезивности опухолевых клеток UMUC-3, клеток RT112 и клеток TCCSUP было зарегистрировано после 24-часовой или 2-недельной обработки амигдалином. Снижение миграции было отмечено для первых двух раковых клеток, но TCCSUP показал увеличение миграционного свойства [5]. Авторы предположили, что противораковая активность амигдалина может быть специфична для некоторых линий раковых клеток. Такой же случай был зарегистрирован с клетками рака шейки матки, где амигдалин показал терапевтический эффект против линии клеток Hela, но не против клеток FL [4].
Сообщалось, что рацемизация амигдалина в нео-амигдалин в водном растворе препятствует его противораковой активности в клетках промиелоцитарного лейкоза [34]. Было должным образом сообщено, что хроматография ВЭЖХ выявила экстракт амигдалина из семени Persicae как активную форму D, и поэтому экстракт кипятили для ингибирования процесса эпимеризации перед нанесением его на клетки промиелоцитарного лейкоза (HL-60). Также было зафиксировано увеличение гибели клеток, что, как предполагалось, было вызвано процессом апоптоза. Кроме того, также сообщалось о замеченных морфологических изменениях в ядре и фрагментации ДНК клеток [34]. Терапевтический эффект амигдалина был также продемонстрирован для клеток немелкоклеточного рака легких (НМРЛ) линии H1299 и PALM in vitro [35]. Антипролиферация клеток происходила при высокой концентрации амигдалина, ингибирование миграции и инвазивности происходило при низкой концентрации раствора.
6.1 Амигдалин задерживает прогрессирование клеточного цикла в некоторых раковых клетках
Амигдалин также проявляет свою противоопухолевую активность посредством влияния или модификации некоторых белков, участвующих в клеточном цикле. Помимо индукции апоптоза клеток PC3 и LNCaP при раке простаты после лечения в течение как 24 часов, так и 2 недель, амигдалин также, как сообщалось, вызывал снижение клеток фазы G2/M и повышение клеток фазы G0/G1 [5]. Кроме того, была также отмечена модуляция некоторых белков клеточного цикла, таких как циклины, cdks. Тот же случай был зарегистрирован в клетках рака толстой кишки, где наблюдалась пониженная регуляция некоторых белков цикла, в основном экзонуклеазы, топоизомеразы и связывающего белка в обработанных амигдалином клетках SNu-C4 [36]. Авторы использовали анализ микрочипов кДНК для выражения пониженной регуляции белков, и снижение уровня их мРНК также было отмечено с помощью анализа ОТ-ПЦР.
7. Амигдалин в клинических испытаниях
Один из ранних сторонников лаэтрила (химически модифицированная форма амигдалина), как сообщается, сказал, что «лаэтрил работает», это была одна из трех причин, по которым он выживал в течение многих лет [37]. Более того, сэр Эрнст Кребс-младший, который, как говорили, считал, что рак имеет дефицит витамина, предположил, что амигдалин может быть недостающим витамином. Он публично заявил, что лаэтрил является витамином B17, и это было принято многими американцами и политическими деятелями в середине 1970-х годов, но позже критически опровергнуто через некоторое время.
Недавно опубликованный обзор «Амигдалин: шарлатанство или лекарство» Блахеты и др. предоставил общие и актуальные знания об испытаниях амигдалина. В обзоре после рассмотрения обрывков журналов из базы данных Pubmed и соответствующих интернет-источников сообщалось, что нет никаких надлежащих и убедительных доказательств того, что амигдалин может положить конец этому смертельному системному заболеванию, и, таким образом, это решение остается неокончательным. Было сказано, что клиническое испытание на онкологических пациентах показало, что он не вызывает апоптоза или регрессии опухоли в раковых клетках, особенно на последней стадии. Однако авторы также пришли к выводу, что очищенный амигдалин при введении не вызывает токсичности для нормальных клеток. Кроме того, автор не установил терапевтический потенциал амигдалина при многократном введении.
Другая группа исследователей из Cancer Networks отвергла лаэтрил, химически модифицированную форму амигдалина, как лекарство от рака. Это было приписано тем же ложным убеждениям, которые люди имеют о СПИДе как болезни, пропагандируемой для искоренения чернокожих людей, и о том, что аутизм был вызван вакцинами. Сообщалось, что лаэтрил не дал результатов у 175 клинических пациентов и в 20-летних исследованиях на животных [6]. Однако его недавнее широкое использование было приписано мошенническим интернет-источникам, которые представили его как основное лекарство от рака, а не альтернативную терапию [6]. Также было заявлено, что лаэтрил не может быть подкреплен никакими клиническими данными после изучения около тридцати отчетов из разных публикаций [7]. Автор утверждал, что может быть разница между амигдалином и его предполагаемыми химически полученными соединениями лаэтрил, продаваемыми на рынке.
8. Обсуждение и перспективы на будущее
Роль амигдалина в лечении рака вызвала критические дебаты среди ученых со множеством противоречивых публикаций и перекрестных разговоров о его токсичности. Несколько экспериментальных результатов, особенно in vitro, подтвердили противоопухолевую активность амигдалина. Тем не менее, его противоопухолевая активность неубедительна из-за неудач клинических испытаний и токсичности при больших дозировках [13, 38, 39]. Амигдалин был хорошо известен среди онкологических больных в 1970-х годах, где он в основном использовался как одно из дополнительных и альтернативных лекарств от рака [1, 6]. Однако его использование угасло через несколько десятилетий, но недавно возобновилось из-за интернет-рекламы, которую многие исследователи считали мошенничеством из-за некачественных научных отчетов относительно его эффективности [1]. Многие критики амигдалина по-прежнему полагались на устаревшие научные доказательства, которые могли ограничить его исследовательский охват [1]. Противораковый потенциал амигдалина не следует недооценивать, особенно с учетом того, что его апоптотическое действие было продемонстрировано на различных типах рака in vitro . Кроме того, его терапевтический эффект на ксенотрансплантаты клеток Hela in vivo также был проведен [4]. Установлено, что недавние тщательные клинические исследования его противоопухолевого эффекта и токсичности не проводились, и многие новые научные подходы не были направлены на его изучение [1, 13]. Антитело может быть полезным для безопасной доставки амигдалина без токсичности, но ни одно клиническое исследование не доказало этого, чтобы сделать возможным его терапевтическое использование [2]. До сих пор нет удовлетворительного ответа на его противоопухолевый эффект и токсичность, но мы надеемся прояснить эту неопределенность после достаточного количества исследований in vivo и клинических исследований.
|
Эффекты амигдалина |
Раковые клетки |
|
Снижение регуляции белка BcL-2 и повышение регуляции белков Bax, увеличение ферментов каспазы 3 |
Клетки рака простаты человека, клетки линии Hela рака шейки матки, клетки трижды негативного рака молочной железы (TNBC), |
|
Уменьшение количества клеток фазы G2/M и увеличение количества клеток фазы G0/G1, снижение уровня некоторых белков цикла, таких как экзонуклеаза, топоизомераза и связывающие белки |
Клетки рака простаты человека и клетки рака толстой кишки |
|
Регуляция сигнальных путей клеток и ингибирование адгезии опухолевых клеток |
Клетки тройного негативного рака молочной железы (TNBC), клетки рака мочевого пузыря и клетки немелкоклеточного рака легких (NSCLC) |
|
Цитотоксичность, морфологические изменения раковых клеток и снижение миграции раковых клеток |
Промиелоцитарный лейкоз, клетки тройного негативного рака молочной железы (TNBC) и клетки немелкоклеточного рака легких (NSCLC) |
Таблица 1: Сводка противораковых эффектов амигдалина in vitro.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
IO является получателем стипендии AUC African Graduate Fellowship (AGF), а AA — получателем внутреннего гранта AUC.
Ссылки
- Блахета РА, Нельсон К, Хаферкамп А и др. Амигдалин, шарлатанство или лекарство?. Фитомедицина 23 (2016): 367-376.
- Джасвал В., Паланивелу Дж. К. Р. Влияние микробиоты кишечника на амигдалин и его использование в качестве противораковой терапии: содержательный обзор ключевых компонентов, участвующих в изменении эффективности и токсичности дозы. Biochem. Biophys. Rep 14 (2018): 125-132.
- Strugala GJ, Rauws AG, Elbers R. Кишечный метаболизм амигдалина первого прохождения у крыс in vitro. Biochem. Pharmacol 35 (1986): 2123-2128.
- Chen Y, Ma J, Wang F и др. Амигдалин индуцирует апоптоз в клетках линии рака шейки матки человека HeLa. Иммунофармакол. Иммунотоксикол 35 (2013): 43-51.
- Макаревич Дж., Цаур И., Юнгель Э. и др. Амигдалин задерживает прогрессирование клеточного цикла и блокирует рост клеток рака простаты in vitro. Life Sci 147 (2016): 137-142.
- Кассилет Б. Р., Яретт II Р. Шарлатанство в лечении рака: постоянная популярность бесполезных, нерациональных альтернативных методов лечения. Онкология 26 (2012).
- Милаццо С., Лежен С., Эрнст Э. Лаэтрил при раке: систематический обзор клинических данных. Поддержка. Уход за раком 15 (2007): 583-595.
- Newton GW, Schmidt ES, Lewis JP и др. Исследования токсичности амигдалина на крысах предсказывают хроническое отравление цианидом у людей. West J Med 134 (1981): 97.
- Хайсман Д.Р., Найт Д.Дж. Ферментативный гидролиз амигдалина. Biochem. J 103 (1967): 528.
- Ли X, Лю C, Чжан R и др. Определение и фармакокинетика амигдалина у крыс методом ЖХ-МС-МС. J. Chromatogr. Sci 52 (2013): 476-481.
- Шим SM, Квон Х. Метаболиты амигдалина в моделируемых пищеварительных жидкостях человека. Int. J. Food Sci. Nutr 61 (2010): 770-779.
- Do JS, Hwang JK, Seo HJ и др. Противоастматическая активность и селективное ингибирование реакции Т-хелперов 2-го типа водным экстрактом семени Armeniacae Amarum. Иммунофармакол. Иммунотоксикол 28 (2006): 213-225.
- Сонг Z, Сюй X. Расширенные исследования противоопухолевых эффектов амигдалина. J. Cancer Res. Ther 10 (2014): 3-7.
- Chang L, Zhu H, Li W и др. Защитное действие амигдалина на альвеолярные эпителиальные клетки II типа, подвергшиеся воздействию гипероксии, выделенные из легких недоношенных крыс in vitro. Zhonghua Er Ke Za Zhi Chin. J. Pediatr 43 (2005): 118-123.
- Hwang HJ, Lee HJ, Kim CJ и др. Ингибирующее действие амигдалина на экспрессию мРНК TNF-альфа и IL-1бета, индуцируемую липополисахаридом, и артрит у крыс, вызванный каррагинаном. J Microbiol Biotechnol 18 (2008): 1641-1647.
- Yang HY, Chang HK, Lee JW и др. Амигдалин подавляет вызванную липополисахаридом экспрессию циклооксигеназы-2 и индуцибельной синтазы оксида азота в микроглиальных клетках мыши BV2. Neurol. Res 29 (2007): 59-64.
- Чжу Ю.П., Су З.В., Ли Ч. Анальгетический эффект и отсутствие физической зависимости от амигдалина. Чжунго Чжун Яо За Чжи Чжунго Чжунъяо Зажи Китай Дж. Чин. Матер. Медика 19 (1994): 105-107.
- Цзяган Д., Ли Ч., Ван Х. и др. Амигдалин опосредует облегчение атеросклероза у мышей с дефицитом аполипопротеина Е посредством индукции регуляторных Т-клеток. Biochem. Biophys. Res. Commun 411 (2011): 523-529.
- Барони А., Паолетти И., Греко Р. и др. Иммуномодулирующие эффекты набора аналогов амигдалина на клетки кератиноцитов человека. Exp. Dermatol 14 (2005): 854-859.
- Mirmiranpour H, Khaghani S, Zandieh A, et al. Амигдалин ингибирует ангиогенез в культивируемых эндотелиальных клетках диабетических крыс. Indian J. Pathol. Microbiol 55 (2012): 211.
- Бисли ДМГ, Гласс Висконсин. Отравление цианидом: патофизиология и рекомендации по лечению. Occup. Med 48 (1998): 427-431.
- Картер Дж. Х., Маклафферти МА, Голдман П. Роль желудочно-кишечной микрофлоры в токсичности цианида, вызванной амигдалином (лаэтрилом). Biochem. Pharmacol 29 (1980): 301-304.
- Коутс М.Е., Уокер Р. Взаимоотношения между желудочно-кишечной микрофлорой и непитательными компонентами рациона. Nutr. Res. Rev 5 (1992): 85-96.
- Chong ESL. Потенциальная роль пробиотиков в профилактике колоректального рака: обзор возможных механизмов действия. World J. Microbiol. Biotechnol 30 (2014): 351-374.
- Бромли Дж., Хьюз Б.Г., Леонг Д.К. и др. Угрожающее жизни взаимодействие между дополнительными лекарственными средствами: токсичность цианида после приема амигдалина и витамина С. Ann. Pharmacother 39 (2005): 1566-1569.
- Чан Т.Ю. Вероятный случай периферической нейропатии, вызванной амигдалином, у вегетарианца с дефицитом витамина В12. Ther. Drug Monit 28 (2006): 140-141.
- Оеволе О.И., Олайинка Э.Т. Гидроксокобаламин (витамин B12a) эффективно снижает степень отравления цианидом, возникающего при пероральном приеме амигдалина у крыс. J. Toxicol. Environ. Health Sci 1 (2009): 008-011.
- Way JL. Цианидная интоксикация и механизм ее антагонизма. Annu. Rev. Pharmacol. Toxicol 24 (1984): 451-481.
- Хандекар Дж. Д. Токсичность амигдалина (лаэтрила) у грызунов. JAMA 243 (1980): 2396-2396.
- Сток CC. Токсичность амигдалина (лаэтрила) у грызунов. JAMA 242 (1979): 2287-2287.
- Стир TE, Джонсон IT, Джи JM и др. Метаболизм соевого изофлавонового гликозида генистина in vitro кишечными бактериями человека и влияние пребиотиков. Br. J. Nutr 90 (2003): 635-642.
- Chang HK, Shin MS, Yang HY и др. Амигдалин индуцирует апоптоз посредством регуляции экспрессии Bax и Bcl-2 в клетках рака простаты человека DU145 и LNCaP. Biol. Pharm. Bull 29 (2006): 1597-1602.
- Ли Х. М., Мун А. Амигдалин регулирует апоптоз и адгезию в клетках тройного негативного рака молочной железы Hs578T. Biomol. Ther 24 (2016): 62.
- Хи-Янг К., Сон-Пё Х., Донг-Хун Х. и др. Индукция апоптоза экстрактом Persicae Semen в клетках промиелоцитарного лейкоза человека (HL-60). Arch. Pharm. Res 26 (2003): 157.
- Qian L, Xie B, Wang Y и др. Ингибирование инвазии клеток немелкоклеточного рака легких in vitro с помощью амигдалина. Int. J. Clin. Exp. Pathol 8 (2015): 5363.
- Park HJ, Yoon SH, Han LS и др. Амигдалин ингибирует гены, связанные с клеточным циклом в клетках рака толстой кишки человека SNU-C4. World J. Gastroenterol. WJG 11 (2005): 5156.
- Лернер И. Дж. Причины шарлатанства в области рака. Cancer 53 (1984): 815-819.
- Barwina M, Wiergowski M, Sein JA. Случайное отравление семенами персика, используемыми в качестве противораковой терапии – отчет о двух случаях. Przegl. Lek 70 (2013): 687-689.
- Шилс М.Е., Герман М.Г. Недоказанные диетические утверждения при лечении пациентов с раком. Bull. NY Acad. Med 58 (1982): 323.
Амигдалин как перспективный противораковый агент: молекулярный Механизмы и будущие перспективы развития Новые наноформулы для его доставки
преведено с английского SAID-lab.com
Амигдалин как перспективный противораковый агент:
молекулярный Механизмы и будущие перспективы развития Новые наноформулы для его доставки
Аннотация: Уровень заболеваемости раком растет, и рак является одной из основных причин смертности во всем мире. Амигдалин, также известный как витамин B17 (и лаэтрил, синтетическое соединение), представляет собой цианогенное гликозидное соединение, которое в основном содержится в ядрах и мякоти фруктов. Это соединение на протяжении десятилетий предлагалось как многообещающее природное вещество, которое может оказывать противораковое действие. Это всеобъемлющий обзор, в котором критически обобщаются и тщательно анализируются имеющиеся исследования, изучающие противораковый эффект амигдалина, подчеркиваются его потенциальные противораковые молекулярные механизмы, а также необходимость создания нетоксичной рецептуры этого вещества. Углубленное исследование проводилось с использованием наиболее точных научных баз данных, например, PubMed, Cochrane, Embase, Medline, Scopus и Web of Science, с применением эффективных, характерных и релевантных ключевых слов. Есть несколько доказательств, подтверждающих идею о том, что амигдалин может оказывать противораковое действие при раке легких, молочной железы, простаты, колоректального рака, рака шейки матки и желудочно-кишечного тракта. Сообщалось, что амигдалин индуцирует апоптоз раковых клеток, ингибируя пролиферацию раковых клеток и замедляя метастатическое распространение опухоли. Однако на моделях животных in vivo было проведено лишь несколько исследований , а клинические исследования остаются еще более скудными. Имеющиеся данные не могут поддержать рекомендации по использованию пищевых добавок с амигдалином из-за его цианогруппы, которая вызывает неблагоприятные побочные эффекты. Предварительные данные показали, что использование наночастиц может быть многообещающей альтернативой для усиления противоракового эффекта амигдалина при одновременном снижении его неблаго Амигдалин, по-видимому, является многообещающим природным агентом против развития и прогрессирования раковых заболеваний. Тем не менее, существует большая потребность в исследованиях на животных in vivo , а также клинических исследованиях на людях для изучения потенциальной эффективности профилактики и/или лечения амигдалина против рака. Более того, амигдалин можно использовать в качестве ведущего соединения, эффективно применяя последние разработки в процессах разработки лекарств.
- Введение
Характеристика глобальных изменений бремени болезней и тенденций с течением времени дает важную информацию об этиологии рака и служит основой для стратегий профилактики и лечения. Злокачественные новообразования считаются основной причиной смертности во всем мире; число новых случаев рака во всем мире достигло 19,3 миллиона, и в 2020 году умерло почти 10 миллионов человек [1]. Вызывают тревогу новые данные, согласно которым число новых случаев заболевания с 2020 по 2040 год во всем мире составит 28,4 миллиона человек [2]. Кроме того, самые последние данные Всемирной организации здравоохранения (ВОЗ) показывают, что рак молочной железы остается наиболее распространенным злокачественным заболеванием у женщин в 158 из 183 стран (86%) и основной причиной смертности от рака в 173 из 183 стран.
95%) [3]. По данным Глобальной статистики рака 2020 года (GLOBOCAN) второй наиболее распространенной причиной смертности от рака во всем мире и третьей по распространенности злокачественной опухолью с точки зрения диагностики является колоректальный рак [1,4]. Более того, текущие модели смертности и долгосрочные тенденции для основных типов рака в 47 странах мира, исключая Африку, показывают, что уровень заболеваемости раком, связанным с инфекциями, таким как рак шейки матки и рак желудка, и раком, связанным с курением, таким как рак легких и пищевода, увеличились примерно в 10 раз [5]. В Европейском Союзе (ЕС) общее прогнозируемое число смертей от рака в 2023 году оценивается в 1 261 990 (702 214 среди мужчин, 559 776 среди женщин) [6]. Общая смертность от рака в 2022 году оценивалась в 1 269 200 [7], при этом колоректальный рак и рак легких были ведущими причинами смертности от рака (>30%)в ЕС. В Греции число новых случаев в 2020 г. составило 64 530, а количество смертей — 33 166 [5–7]. В США число новых случаев рака в 2023 году составит примерно 1 958 310, или примерно 5 370 случаев в день [8]. В этом контексте следует отметить, что эти оценки случаев на 2023 г. основаны
на недавно доступных данных о заболеваемости до 2019 г. и не учитывают влияние пандемии COVID-19 на
Соответственно, прогноз смертности от рака в 2023 году основан на данных до 2020 года [8].
Темой, представляющей интерес, является роль амигдалина, также известного как витамин B17 или лаэтрил (его синтетическое соединение), в профилактике и/или совместном лечении рака. Несколько исследований продемонстрировали широкий спектр биологических свойств амигдалина, предполагая, что он может оказывать профилактическое или даже сопутствующее воздействие на рак шейки матки, молочной железы, простаты, легких и мочевого пузыря, что в основном можно объяснить ингибированием рака. пролиферация клеток [9–13]. Как in vitro , так и in vivo оценки биологического действия экстрактов амигдалина из трех сортов маниоки (Manihot esculenta), выращенных в Бенине, продемонстрировали, что эта встречающаяся в природе молекула может эффективно действовать в профилактике рака и совместном лечении, подавляя образование раковых клеток [14]. ]. Исследования in vitro задокументировали индукцию апоптоза амигдалином из-за увеличения экспрессии белка Bax и каспазы-3 и снижения экспрессии антиапоптотического белка Bcl-2 [15,16]. В области химиопрофилактического потенциала амигдалина Erikel et al. (2023) отметили, что амигдалин может оказывать модулирующее действие на химиотерапевтические агенты, которые, по-видимому, вызывают геномные повреждения лимфоцитов человека [17].
Основные противораковые молекулярные механизмы амигдалина в основном связаны с ингибированием клеточного цикла, индукцией апоптоза, стимуляцией цитотоксического эффекта и регуляцией иммунной функции в организме человека [15,18,19]. Более того, основным молекулярным механизмом апоптоза является активация протеазы каспазы-3, которая инициируется клеточной репликацией белка Bax цитохрома С [20]. Высокая экспрессия проапоптотического белка Bax связана с апоптозом и последующей пролиферацией клеток [ 21]. В связи с этим считается, что амигдалин индуцирует апоптоз за счет увеличения активности каспазы-3 в клетках HeLa и подавления Bcl-2 [22]. Параллельно выяснилось, что Bax активируется в клетках HeLa, обработанных амигдалином, что позволяет предположить, что в апоптозе может быть задействован эндогенный путь [22]. Несколько линий клеток человека, в том числе раковых клеток легких, молочной железы, толстой кишки, яичек, предстательной железы, прямой кишки и мочевого пузыря, показали, что амигдалин может вызывать апоптоз и остановку клеточного цикла [19,20,22–26].
Несмотря на многообещающие результаты имеющихся в настоящее время исследований по изучению противораковых
эффектов амигдалина, существует большая потребность в дальнейших исследованиях по этой теме. На сегодняшний день Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) не одобрило медицинское использование амигдалина.
при одновременном лечении рака или других заболеваний в США, поскольку отсутствия адекватных данных об эффективности амигдалина и риске потенциального
неблагоприятные побочные эффекты [27,28]. В связи с этим целью настоящего обзора было критически обобщить и тщательно изучить имеющиеся данные о потенциальных противораковых эффектах амигдалина, подчеркивая его противораковые молекулярные механизмы и его возможное будущее применение в клинической практике борьбы с раком.
- Методы
Всесторонний и углубленный обзор был проведен с использованием наиболее точных научных баз данных, например, PubMed, Scopus, Web of Science и Google Scholar, с применением
эффективные, характерные и релевантные ключевые слова, такие как «амигдалин» или «лаэтрил» или «витамин B17» и «токсичность», «противоопухолевые эффекты» и/или «рак» и «молекулярные механизмы».
Критериями включения были исследования, написанные на английском языке, клинические исследования на людях,
исследования на животных in vitro и in vivo , а также рандомизированные клинические исследования (РКИ). Серая литература,
комментарии, редакционные статьи, письма в редакцию, рецензии, тезисы в материалах конференций,
а статьи в нерецензируемых журналах были исключены из окончательного анализа.
поиск был дополнен сканированием списков литературы соответствующих исследований и ручным
поиск ключевых журналов, комментариев, редакционных статей и тезисов в материалах конференций . Полученные опросы были дополнительно тщательно проверены на предмет наличия соответствующих исследований.
цитируются в их тексте.
Все авторы выступали в качестве рецензентов. Чтобы повысить согласованность действий рецензентов, все рецензенты
проверил все полученные публикации, обсудил результаты и внес изменения в процедуру проверки и
руководство по извлечению данных перед началом проверки для этого обзора. Все рецензенты работали в парах последовательно оценить названия, аннотации, а затем полные тексты всех публикаций
выявленные в ходе поиска потенциально релевантных публикаций. Мы разрешили разногласия по
отбор исследований и извлечение данных путем консенсуса и обсуждения со всеми авторами/рецензентами,
если нужно. Форма диаграммы данных была совместно разработана двумя рецензентами (MS и CG) для
определить, какие переменные следует извлечь. Два рецензента независимо друг от друга составили диаграммы данных.
обсуждали результаты и постоянно обновляли форму диаграммы данных в рамках итеративного процесса.
- Результаты
3.1. Амигдалин: основная информация и свойства
Амигдалин был открыт в 1803 году Шрейдером при исследовании ингредиентов горького миндаля.
и был впервые выделен в 1830 году двумя французскими химиками, Пьером-Жаном Робике и Антуаном.
Франсуа Бутрон-Шарлар [29,30]. Химики Хауорт и Уайлам наконец определились.
его точная химическая структура в 1923 году (рис. 2) [31]. Амигдалин (d-манделонитрил-β-d- глюкозид-6-β-глюкозид) представляет собой цианогенное гликозидное соединение, состоящее из дибензальдегида , синильной кислоты и двух молекул глюкозы (D-манделонитрил-β-D-глюкозид- 6 -глюкозид). β-глюкозид) [32]. Его биоактивная форма (D-манделонитрил-β-глюкоза) была использована в
Патент штата (USP). Лаэтрил — частично искусственная, синтетическая форма природного вещества.
амигдалин (рис. 2) [32]. В Мексике структура была дифференцирована и определена как D- манделонитрил-β-гентиобиозид [33]. Национальный центральный институт США (NCI) продемонстрировал
что мексиканская форма амигдалина (пероральная и внутривенная) не соответствует требованиям препарата США. стандартам, и это вещество было запрещено для потребления человеком [33]. Амигдалин в основном содержится в ядрах и мякоти таких фруктов, как сливы, абрикосовые косточки, черешня, персики.
Цитотоксический эффект амигдалина на раковые клетки in vitro и распределение амигдалина в растениях, которые
Содержаниеобычнопотребляютсяамигдалинаврационеврастенияхчеловека,являются,которыедвумяобычноизних.употребляются в пищу человеком, являются
наиболеедвумянаиболееинтересныеинтереснымитемыпоследнихтемамиисследованийнедавнихиссле.Однакоованийэто. Однаконеновоеэтосоединениеновое,соединениеоновеками, и оно имеет использовалось в традиционной и альтернативной медицине из-за его противораковых и противораковых свойств. использовался в традиционной и альтернативной медицине на протяжении веков благодаря своим противораковым
противовоспалительнымьныесвойствам и, в целом,,многочисленнымегомногочисленныемедицинскицинскиемпреимуществампреимущества[35,36,38][35,36,38].Это.
Это помогло облегчить боль и лихорадку; подавление кашля, жажды и тошноты; и в качестве
помог облегчить боль и лихорадку; подавление кашля, жажды и тошноты; и средство для профилактики
- сопутствующего лечения рака в последние годы [39,40].
- качестве средства профилактики и сопутствующего лечения рака в последние годы [39,40].
3.2. Противораковые эффекты и молекулярные механизмы амигдалина: данные in vitro и in vivo
3.2. Противораковые эффекты и молекулярные механизмы амигдалина: данные in vitro и in vivo
На сегодняшний день в нескольких исследованиях изучались потенциальные противораковые эффекты амигдалина.
На сегодняшний день несколько исследований изучили потенциальные противораковые эффекты амигдалина,
подчеркнув его противораковые молекулярные механизмы, особенно в легких, молочной железе, предстательной железе,
подчеркивая его противораковые молекулярные механизмы, особенно при раке легких, молочной железы, предстательной
железы, колоректального рака, рака шейки матки и желудочно-кишечного тракта. Потенциальные противораковые эффекты и
рак прямой кишки, шейки матки и желудочно-кишечного тракта. Потенциальные противораковые
эффекты и молекулярные механизмы амигдалина изображены на рисунке 3. Клинические исследования на людях
Механизмы действия амигдалина изображены на рисунке 3. Клинические исследования на людях, а
также на раковых клетках человека и животных представлены в таблице 1.
а также в раковых клетках человека и животных представлены в табл. 1.
3.2.1. Рак легких
Амигдалин может быть полезен в качестве вспомогательного терапевтического средства при опухолях легких.
Этот ком- 3.2.1. Рак легких
фунт значительно индуцировал апоптоз клеток рака легких A549 и PC9 в определенной дозе. Амигдалин может быть полезен в качестве совместного терапевтического агента при опухолях легких. Этот взаимозависимый путь посредством митохондриально-опосредованного и каспазозависимого апоптоза
значительно индуцировал апоптоз клеток рака легких A549 и PC9 в дозовом пути [41]. Одновременно в клетках рака легких A549 и PC9 наблюдалось увеличение цитохрома C и усиление каспазозависимой активности посредством
митохондриально-опосредованной и каспазозависимой активности апоптоза 9 и каспазы-3. В пробирке
путь [41]. Одновременно увеличение цитохрома С и усиление каспаз- ингибирования пролиферации клеточных линий рака легкого H1299/M и PA/M требовали высокой
Активность 9 и каспазы-3 наблюдалась в клетках рака легких A549 и PC9. In vitro ингибируют концентрацию амигдалина [42]. Однако при более низкой концентрации амигдалина это было
Для пролиферации клеточных линий рака легких H1299/M и PA/M требовалась высокая концентрация. Было обнаружено, что инвазионная и миграционная способность раковых клеток H1299/M PA/M была
амигдалина [42]. Однако при более низкой концентрации амигдалина наблюдалось его значительное ингибирование [42]. Таким образом, было высказано предположение, что амигдалин, вероятно, обладает способностью к инвазии и
миграции раковых клеток H1299/M PA/M, обладая значительной временной метастатической активностью, индуцируя апоптоз и ингибируя пролиферацию рака легких.
отношенииингибируетсяклеток[42]. [42]Таким. образом, было высказано предположение, что амигдалин, вероятно, обладает антиметастатической активностью в
индуцируя апоптоз и ингибируя пролиферацию клеток рака легких [42].
3.2.2. Рак молочной железы
3.2.2. Рак молочной железы
Было показано, что амигдалин индуцирует апоптоз и ингибирует адгезию молочной железы.
Примечательнозначительн,что усиливалобоих апоптоз путем подавления пролиферации клеток и повышения эффективности лучевой терапии за счет индукции остановки клеточного цикла (на стадиях клеточного цикла G1 и суб-G1) [11]. Также было обнаружено, что амигдалин снижает миграцию клеток MDA-MB-231 в большей степени, чем клеток MCF-7 [43]. Кроме того, было высказано предположение, что ингибирование протеолитических ферментов способствует активации апоптотических событий в клетках рака молочной железы MCF-7 [44]. Кроме того, было показано, что амигдалин увеличивает экспрессию Bax и снижает экспрессию Bcl-2 в клетках рака молочной железы SK-BR-3 и MCF-7. Однако по сравнению с конъюгатом аффитела амигдалин-ZHER2 влияние на экспрессию Bax и Bcl-2 в клетках SK-BR-3 было сильнее, чем в клетках MCF-7 [45]. Также была продемонстрирована способность амигдалина уменьшать рост клеток рака молочной железы человека MCF-7 и T47D в зависимости от концентрации путем стимуляции производства малонового диальдегида (MDA) и окисленного глутатиона . Более того, наблюдалось значительное снижение общего уровня глутатиона и активности глутатионредуктазы в клетках рака молочной железы [46].
3.2.3. Рак простаты
Амигдалин дозозависимо ингибировал рост опухоли и уменьшал опухолевые клоны в клеточных линиях рака простаты путем ингибирования фазы G0/G1 [47]. Более того, было очевидно ингибирование роста клеток рака предстательной железы и роста опухоли под действием амигдалина, что указывает на функцию метаболических ферментов бетаглюкозидазы (β-глюкозидазы) и роданезы в регулировании противораковой активности амигдалина in vivo [10]. Активацию амигдалина β -глюкозидазой можно рассматривать как стратегию ферментной/лекарственной терапии, которая может стать новым многообещающим подходом к таргетному лечению рака простаты [48]. Было также обнаружено, что воздействие амигдалина на некоторые клетки рака предстательной железы, такие как DU-145, ингибирует распространение метастазов, чему способствует интегрин α6 [49].
3.2.4. Колоректальный рак
- альтернативной и традиционной медицине амигдалин обычно используется для профилактики и лечения
злокачественных новообразований колоректальных опухолей [50]. Было обнаружено , что противораковый эффект амигдалина на клетки колоректального рака, например, на клетки колоректального рака SNU-C4 человека, усиливается за счет снижения экспрессии генов, связанных с клеточным циклом [51]. Сообщалось, что клетки рака толстой кишки более чувствительны к действию амигдалина по сравнению с нормальными клетками из-за более высокой концентрации β-глюкозидазы и более низких уровней печеночного фермента роданезы, который может превращать цианид в относительно безвредное соединение тиоцианат [52].
3.2.5. Рак шейки матки
Доказано, что амигдалин значительно ингибирует пролиферативную активность клеток рака шейки матки HeLa
- Антиапоптотический белок Bcl-2 подавлялся, а проапоптотический Bax повышался в клетках HeLa, обработанных амигдалином [22]. Более того, соотношение Bax-к-Bcl-2 и активность каспазы-3 увеличивались при обработке амигдалином в клетках HeLa, усиливая апоптотический эффект амигдалина на клетки рака шейки матки [22,53].
3.2.6. Рак желудочно-кишечного тракта
Было продемонстрировано, что амигдалин стимулирует процесс апоптоза путем повышения
экспрессии каспазы-3 и снижения экспрессии Bcl-2, а также ингибирования пролиферации
гепатоцеллюлярных раковых клеток HepG2 и EAC и повышения экспрессии Beclin-1 [54].
Примечательно , что комбинация амигдалина с метформином показала многообещающий эффект
по сравнению с монотерапии амигдалином; их комбинация была более цитотоксичной, демонстрируя
большую способность индуцировать апоптоз и останавливать клеточный цикл в гепатоцеллюлярных раковы
Было показано, что помимо этой комбинации активность амигдалина с цинком приводит к усилению апоптотического эффекта при лечении HepG2 по сравнению с действием амигдалина без цинка [56].
3.2.7. Другие злокачественные
новообразования опухолей. Ингибирующее действие амигдалина на маркеры роста и дифференцировки E- и N-кадгерин в клетках почечно-клеточного рака (ПКР) было также продемонстрировано при применении 10 г/мл амигдалина к клеточным линиям ПКР A498, Caki-1. и KTC-26 в течение 24 часов или 2 недель in vitro [35]. Исследование влияния амигдалина (1,25–10 мг/
мл) на несколько клеточных линий рака мочевого пузыря (UMUC-3, RT112 и TCCSUP) также показало положите
Наиболее заметное воздействие амигдалина связано с осью cdk2-циклин А.
Исследования по нокдауну siRNA показали положительную связь с cdk2/циклином.
Также было обнаружено, что амигдалин ингибирует развитие опухоли за счет подавления CDK2 и циклина [57]. Напротив, колониеобразующие клетки из лейкозных клеточных линий и нормального костного мозга были относительно толерантны к амигдалину и его метаболитам in vitro. Хотя наблюдалось увеличение скорости апоптоза, не наблюдалось избирательного разрушения между линиями лейкозных клеток человека и нормальными клетками костного мозга [58].
Таблица 1. Исследования, оценивающие противораковые эффекты и противораковые молекулярные механизмы амигдалина.
3.3. Токсичность амигдалина.
Чрезмерное употребление амигдалина может привести к отравлению (более 1 мг/л цианида в крови). Амигдалин превращается в глюкозу, бензальдегид и цианистый водород под действием эндогенного фермента (β-глюкозидазы) при измельчении фруктовых косточек. С более аналитической точки зрения, при высвобождении HCN цитохромоксидаза C может реагировать с ионом железа.
Это может индуцировать образование комплексов ионов металлов, которые лизуют клетки и ингибируют синтез АТФ [65].
Сообщалось, что амигдалин оказывает токсическое действие при приеме внутрь с добавками.
Пероральный прием 500 мг амигдалина может привести к высвобождению 30 мг цианида [66].
Токсичность цианидов может быть опасной для жизни из-за снижения утилизации кислорода
митохондриями, что приводит к гибели клеток. В раковых клетках отсутствует родханаза, фермент,
который действует как детоксифицирующий агент, связывая железо-серные центры на клеточных
мембранах и превращая HCN в менее токсичный метаболит – тиоцианат. Однако после парентерального
введения амигдалина/лаэтрила путем инъекции более 80% тиоцианата обнаруживалось в моче крыс и
кроликов [66]. Неблагоприятные побочные эффекты токсичности цианидов включают тахикардию,
спутанность сознания, тошноту, головную боль и, что более серьезно, нейромиопатию, цианоз, кому, судороги и с
За последние десятилетия было проведено несколько исследований in vitro и in vivo с использованием однократных или многократных доз и различных форм введения амигдалина (внутривенных и внутримышечных), которые не выявили образования HCN, что подчеркивает решающую роль кишечника в физиологии организма человека после потребление веществ. Анаэробные бактериальные типы, существующие в кишечнике, обладают высокой активностью β-глюкозидазы, которая необходима амигдалину для гидролиза HCN. Тем не менее, при определенных обстоятельствах было обнаружено, что токсичность HCN существует. В некоторых случаях токсичность была вызвана приемом различных доз амигдалина, и не было побочных эффектов HCN, связанных с высокими дозами. Несколько факторов, в том числе потребление пробиотиков или пребиотиков, диета и возраст, могут изменить кишечный консорциум, который отвечает за условия, при которых возникает токсичность. Примечательно, что не было зарегистрировано серьезных реакций на пероральный прием амигдалина
вдозе 3 г у больных раком, которые искали альтернативные методы лечения. Минимальная смертельная доза амигдалина для взрослого человека составляет 50 мг или 0,5–3,5 мг/кг массы тела. Однако взаимодействие с одновременным употреблением витамина С, по-видимому, активирует его неблагоприятные.
3.4. Клинические исследования амигдалина/лаэтрила при злокачественных новообразованиях опухолей человека в 20 веке
Несколько исследований продемонстрировали противораковую активность амигдалина и его
терапевтическое использование для лечения рака и облегчения боли [30,68]. Хотя научные
доказательства противоракового эффекта амигдалина, основанные на клинических испытаниях,
ограничены, было проведено несколько исследований по изучению влияния амигдалина на злокачественные оп
На протяжении многих лет рассматривалось несколько клинических испытаний комбинации амигдалин/
лаэтрил [32]. В 1980 году отдел исследований лекарственных средств Национального института рака
(NCI) объявил, что около 200 больных раком, «для которых никакое другое лечение не было эффективным», планировалось получить химическое вещество, специальную диету и дополнительные витамины (см . Институт начинает клинические испытания лаэтрила», 1980) [69]. В течение следующих двух лет были проведены два клинических исследования в области применения лаэтрила при раке человека. Первое из этих двух клинических испытаний было проведено в 1981 году на шести пациентах
- поздней стадией рака [32]. Амигдалин вводили как внутривенно, так и перорально в течение 21 дня без признаков токсических реакций. Эти данные согласуются с предыдущими наблюдениями за пациентом после самостоятельного приема лаэтрила [70]. В 1982 году было проведено еще одно клиническое исследование с участием 178 пациентов с раком, которые получали лечение амигдалином плюс «метаболическую терапию» [59]. Никаких существенных преимуществ с точки зрения излечения, улучшения или стабилизации рака, улучшения симптомов, связанных с раком, или увеличения продолжительности жизни не наблюдалось. Опасность терапии амигдалином у нескольких пациентов была подтверждена симптомами токсичности цианида или уровнями цианида в крови, приближающимися к летальному уровню [59,69,70]. Однако следует отметить, что эти клинические испытания были проведены более 40 лет назад и теперь их следует считать устаревшими, что подчеркивает необходимость проведения новых клинических испытаний, включающих введение амигдалина в различных фармацевтических формах, которые могли бы быть более переносимыми и приемлемыми для организм человека, демонстрируя большую биоактивную эффективность и нетоксичные эффекты.
3.5. Наночастицы и амигдалин в 21 веке Наночастицы считаются
многообещающим биотехнологическим методом доставки лекарств и лечения злокачественных опухолей человека, избегая при этом токсичности. Несколько исследований на линиях раковых клеток человека продемонстрировали положительные результаты в отношении метаболизма амигдалина без побочных эффектов. Как уже упоминалось, амигдалин, несмотря на его противораковое действие, столкнулся с противоречиями из-за выделения цианида. Сохаил и Аббас исследовали наночастицы альгината-хитозана (ACNP) как способ введения лекарств посредством инкапсуляции и доставки амигдалина в опухолевые клетки (H1299) [64]. Наночастицы продемонстрировали стабильное высвобождение лекарственного средства в течение десяти часов и значительную скорость набухания в слабокислой и нейтральной среде. Было показано, что ACNP оказывают большее противоопухолевое действие на клеточные линии H1299, чем свободный амигдалин, что предполагает большее поглощение клетками соединения, инкапсулированного в наночастицы. В связи с этим биомиметические и биосовместимые наночастицы бальгината-хитозана могут быть использованы в качестве выгодной системы доставки лекарств для пролонгированной и контролируемой доставки амигдалина с повышенной цитотоксической активностью в отношении опухолевых клеток, одновременно защищая нормальные ткани человека и здоровые клетки [64].
Наночастицы серебра, инкапсулирующие амигдалин и сшивающие микрокапсулы, заряженные хитозаном, также были исследованы в клеточных линиях рака молочной железы. Противораковый ответ также наблюдался в рамках контролируемого высвобождения амигдалина за счет соединения хитозана, преодолевающего низкие цитотоксические эффекты при высоких дозах [63].
Кроме того, наночастицы продемонстрировали устойчивое высвобождение амигдалина и фолиевой кислоты и очевидную селективность в отношении клеток путем подавления роста опухоли. В то же время было обнаружено, что они повышают эффективность лучевой терапии за счет усиления апоптоза, блокирования клеточного цикла и уменьшения пролиферации клеток рака молочной железы за счет
снижения уровня железа и митоген-активируемых протеинкиназ (MAPK/P38). Также была показана амигдалин-фолиев
ингибировать дифференцировку экспрессии комплекса CD4 и CD80, вызывая подавление трансформации фактора роста бета (TGF-бета)/интерлейкин-6, (IL-2)/интерферон-гамма, (INF-g)/интерлейкин-2, и Экспрессия (IL-2)/фактора роста эндотелия сосудов (VEGF) на сигнальном пути при одновременной модуляции экспрессии гена CD8 и группы естественных киллеров 2D [11].
Мосайеби и его коллеги создали наноформулу амигдалина с β-циклодекстрином, чтобы исследовать усиление его действия против миграции клеточной линии MCF-7, апоптоза и миграции генов. Наноформулированный амигдалин показал больший эффект на опухолевые клетки, чем один амигдалин [62].
3.6. Пищевые добавки с амигдалином для лечения рака Амигдалин, лаэтрил
или витамин B17 с 1845 года заявлялись в качестве средства для лечения различных заболеваний, особенно злокачественных опухолей [33]. Однако в 1982 году возникло мнение, что амигдалин может быть токсичным препаратом и неэффективен при лечении рака [59].
Недавние теоретические и практические разработки показали, что амигдалин может оказывать благотворное воздействие на больных раком [28,62,63]. Амигдалин использовался для лечения рака как в виде монотерапии, так и в сочетании с метаболической терапией. Поэтому стоит отметить, что токсичность витаминных добавок не является редким явлением, и амигдалин рекомендуется пациентам в качестве пищевой добавки при раке, при этом предлагаются высокие дозы [71]. Таблетки и капсулы амигдалина в настоящее время продаются как натуральная пищевая добавка под неправильным названием лаэтрил или сомнительным названием «витамин B17» [72].
Некоторые исследования клинических случаев продемонстрировали рецидив метаболического ацидоза после массивной передозировки амигдалина и опасной для жизни токсичности цианидов, включая нефрогенный несахарный диабет [73–76]. Токсичность амигдалина может быть вызвана ядовитым составным продуктом бензальдегида и цианида после перорального приема [35]. Как токсикологи, так и нефрологи должны знать о способности этого «витамина» вызывать отравление цианидами [ 77]. Кроме того, в настоящее время существует серьезная обеспокоенность тем, что натуральные пищевые добавки не подвергаются строгим аналитическим и клиническим испытаниям. В соответствии с Регламентом Европейского Союза ((EC)
- 178/2002), касающимся общего законодательства в области пищевых продуктов, пищевые добавки считаются пищевыми продуктами, а не лекарственными средствами [78]. Согласно приведенным выше данным, предполагающим, что клиническое использование пищевых добавок амигдалина может сопровождаться неблагоприятными побочными эффектами, соотношение риска и пользы не является благоприятным д Более того, амигдалин ошибочно называют витамином B17; соединение не является витамином [36].
- Дискуссия
альтернативной медицине амигдалин уже несколько десятилетий считается противораковым средством без строгого научного подтверждения его эффективности и безопасности. Несколько тематических исследований выявили риск плохо регулируемых добавок [79]. Недавние исследования in vitro продемонстрировали, что амигдалин может оказывать противораковую активность, влияя на клеточный цикл, способствуя апоптозу и цитотоксичности, а также модулируя иммунный ответ [29,80,81].
Однако клинические исследования показали, что метаболиты амигдалина могут превращаться в синильную
кислоту и что накопление синильной кислоты с течением времени может привести к неблагоприятному токсическому эффекту у человека [82].
Более того, доступные в настоящее время исследования имеют некоторые ограничения. На сегодняшний день проведено лишь несколько исследований на животных in vivo . Кроме того, результаты исследований противоречивы, возможно, из-за неоднородности конструкции их методов. Доза, форма вещества, тип введения, отсутствие РКИ на людях, а также отсутствие клинических испытаний фазы III и IV являются существенными ограничениями для рекомендаций по назначению амигдалина для профилактики и/или лечения рака в клинической практике. Таким образом, преимуществом нашей обзорной статьи является выявление пробела в литературе относительно проведения клинических исследований амигдалина. С другой стороны, до сих пор недостаточно надежных данных о биодоступности амигдалина и соответствующих уровнях его концентрац
циркуляция. Соответственно, не существует данных о том, можно ли использовать амигдалин в качестве совместного лечения с другими химиотерапевтическими средствами.
Значительный научно-исследовательский разрыв между концом 20-го века и началом 21-го века возник из-за того, что до сих пор исследовательская деятельность проводилась ограниченно . Более того, большинство исследований, подтверждающих противораковое действие амигдалина, было проведено на различных линиях раковых клеток in vitro. Таким образом, разумно предположить, что его противораковые эффекты не могут быть экстраполированы на человека. Противоречивые результаты исследований in vitro и in vivo [41,51,60,83–86] и нескольких клинических исследований [61] еще раз подчеркивают необходимость дополнительных исследований
- области терапии рака, особенно связанных с изучением новую, нетоксичную формулу амигдалина, принимая во внимание роль нанотехнологий в современную эпоху биомедицинской науки. В целом, существует большая потребность в дальнейших исследованиях на животных in vivo , а также клинических исследованиях на людях для изучения потенциальной эффективности профилактики и/или лечения амигдалина против развития и прогрессирования раковых заболеваний. Кроме того, расхождения, обнаруженные в некоторых клинических исследованиях, могут быть связаны с небольшими размерами выборки, а также с различными персонализированными характеристиками участников , что подчеркивает необходимость проведения хорошо спланированных клинических исследований с адекватными размерами выборки в будущем.
- 2015 году Кокрановская база данных систематических обзоров заявила, что лаэтрил или амигдалин оказывают благоприятное воздействие на больных раком, что в настоящее время не подтверждается научно обоснованными клиническими данными [28]. В приведенном выше отчете документально подтверждено, что существует значительный риск серьезных побочных эффектов от отравления цианидом после введения лаэтрила или амигдалина, особенно после перорального приема
- Таким образом, баланс риска и пользы лаэтрила или амигдалина для лечения рака остается однозначно сомнительным [28]. Однако с 2015 года было проведено много исследований. Более того, Национальный институт рака сообщил, что частота отравлений цианидами намного выше при пероральном приеме лаэтрила, поскольку кишечные бактерии и некоторые часто употребляемые в пищу растения содержат ферменты (бета-глюкозидазы), которые активируют высвобождение цианида после при
Наконец, эффективно применяя последние разработки в процессах разработки лекарств, амигдалин можно использовать в качестве ведущего соединения для синтеза и разработки более биологически активных аналогов, родственных амигдалину, с более высокой эффективностью и целевой селективностью, а также со сниженными нежелательными побочными эффектами и улучшенной биодоступностью при пероральном приеме. Например, в последние годы методы машинного обучения произвели революцию в области разработки лекарств на основе структуры [88].
Подходы искусственного интеллекта для ускорения и предотвращения сбоев в разработке лекарств также могут быть применены в случае амигдалина [89]. Помимо методов машинного обучения и искусственного интеллекта, квантовые вычисления являются еще одним значительным достижением
- области технологий генеративной химии и процессов открытия лекарств, которые исследователи
могут использовать в случае амигдалина [90]. Функционализация на поздней стадии также создает новые проблемы для введения новых групп химических фрагментов, таких как амигдалин и его будущие потенциальные синтетические аналоги, ближе к концу синтетической последовательности, что означает, что новые молекулы, к которым можно быстро получить доступ без трудоемких химических процессов de novo. синтез [91]. Этот конкретный подход может предложить такие преимущества, как эффективный доступ к разнообразным библиотекам для изучения взаимосвязей структура-активность и улучшение физико-химических и фармакокинетических свойств [91].
Компьютерное открытие лекарств также может обеспечить быструю идентификацию весьма разнообразных, мощных, селективных по мишеням и подобных лекарству лигандов белков, открывая новые возможности для экономически эффективной разработки более безопасных и эффективных низкомолекулярных методов лечения, таких как амигдалин . 92]. Липофильность и биомиметические свойства также играют важную разную и перекрывающуюся роль в поддержке процесса открытия лекарств, главным образом за счет увеличения пероральной биодоступности потенциальных лекарств и значительного снижения их потенциальных неблагоприятных побочных эффектов [93,94]. Липофильность имеет уникальную ценность на ранних этапах разработки лекарств для скрининга библиотек и для первоначальной идентификации перспективных соединений, в то время как биомиметические свойства полезны для экспериментальной оценки свойств абсорбции, распределения, метаболизма и выведения (ADME) синтезированных новых соединений. поддержка определения приоритетности потенциальных лекарств и руководство дальнейшим синтезом; эти подходы могли бы
могут быть применены в случае амигдалина для получения новых синтетических аналогов амигдалина с повышенной пероральной биодоступностью и уменьшенными нежелательными побочными эффектами [93,94].
- поддержку вышеизложенных соображений недавно были применены модели двойного докинга и молекулярной динамики для разработки новых подходов к объяснению влияния амигдалина на динамическое поведение комплекса Bcl-2/BAX, каспазы-3 и PARP- 1 . 95]. Эти молекулярные мишени могут играть определяющую роль в путях апоптоза и могут рассматриваться как потенциальные терапевтические мишени для лечения рака [95]. В целом, эти компьютерные наблюдения можно считать хорошим доказательством отказа от убеждения, что цианогруппа амигдалина, которая является основной группой, ответственной за противораковую активность амигдалина [95], может быть заменена другой химической группой с меньшими побочными эффектами. [96,97]. Кроме того, результаты вычислений подтвердили, что амигдалин имеет уникальную структуру и может считаться эталонным соединением для разработчиков лекарств
при разработке новых молекул со схожими эффективными противораковыми химическими структурами, но с меньшими неблагоприятными побочными эффектами [95–97].
- Выводы
- настоящее время имеется несколько линий данных in vitro , свидетельствующих о том, что
амигдалин и его синтетический аналог лаэтрил обладают противораковыми свойствами, а предыдущие и предстоящие исследования на животных in vivo , по-видимому, подтверждают их противораковые свойства. Однако существуют определенные возникающие и серьезные проблемы, связанные с их токсичностью из-за их цианогруппы, а также из-за плохой биодоступности при пероральном приеме. В связи с этим необходимо эффективно применять новые технологии при разработке лекарств, чтобы свести к минимуму их неблагоприятные побочные эффекты, а также повысить их пероральную биодоступность. В связи с этим химики-медики должны сосредоточиться на лабораторном синтезе химических аналогов, которые могли бы поддерживать противораковую активность амигдалина, одновременно снижая его неблагоприятные побочные эффекты. Технология наночастиц кажется многообещающей для увеличения биодоступности и противораковой активности амигдалина при одновременном снижении его токсических эффектов. Однако в литературе существует значительный пробел, касающийся проведения клинических испытаний по изучению его противораковой активности на людях и обеспечению безопасности амигдалина до его внедрения в клиническую практику. Сочетание технологии наночастиц с использованием новых и более безопасных синтетических аналогов амигдалина.

:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/jl0bz7783moko4sosscs0cg4co4cko)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/jjk9pgt4rjks8kk080gsok8wsocsk4)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/q8jqa0vhgusskckcg4os4cg04gc40o)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/nuvgpvrk58g0o4wswkgoswkok8woow)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/g7si66qhpa80k0w0cscswcks88gkcs)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/rkymblyu0kgkwk8os0o4w0kwogwgg8)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/35j0xxi7vjswk4ws4wwgwwgck04808)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/4hzez0t7k36s0s8gk880gwwgkocgcg)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/36pldriev5kw0wos04088woc0c8cko)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/oa48l4qf0ao4wsckog4scs0g4sockk)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/4iqo1vwn9c000o8kckkok4w4go80go)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/77hvbkwf3yscwc8kwoggkgg8o080oo)
:format(png):watermark(,-1,-1,0,15,none)/s2.siteapi.org/232e5eba0b5e408/img/d8bp6bpuiq88g4s48o8c4w0gkkswoo)