Долгосрочная стабилизация метастатической меланомы с помощью дихлорацетата натрия
Акбар Хан, Дуг Эндрюс, Джилл Шейнхаус, Аннеке С. Блэкберн
Акбар Хан, Дуглас Эндрюс, Medicor Cancer Centres Inc., Торонто, Онтарио M2N 6N4, Канада
Джилл Шейнхаус, Insight Naturopathic Clinic, Торонто, ON M4P 1N9, Канада
Аннеке С. Блэкберн, Школа медицинских исследований Джона Кертина, Австралийский национальный университет, Канберра, ACT 2601, Австралия
Вклад авторов: Хан А. лечил пациента и написал большую часть отчета о случае; Эндрюс Д. помогал в разработке протокола натурального лечения для снижения побочных эффектов DCA и написал часть отчета о случае; Шейнхаус Дж. лечил пациента с помощью натуральной терапии; Блэкберн А.С. интерпретировал отчет о случае в контексте литературы по исследованиям DCA in vitro и in vivo, написал части введения и обсуждения, а также просмотрел рукопись в целом.
Заявление об информированном согласии: Пациентка, описанная в данной рукописи, дала согласие на публикацию своего случая анонимно.
Заявление о конфликте интересов: Один из авторов (Хан) проводит терапию дихлорацетатом для онкологических больных через онкологические центры Medicor Cancer Centres за плату и без получения прибыли. Клиника принадлежит члену семьи этого автора. Другим авторам нечего раскрывать.
Открытый доступ: эта статья является статьей открытого доступа, которая была выбрана внутренним редактором и полностью проверена внешними рецензентами. Она распространяется в соответствии с лицензией Creative Commons Attribution Non Commercial (CC BY-NC 4.0), которая позволяет другим распространять, перерабатывать, адаптировать, строить на основе этой работы некоммерческие работы и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа должным образом цитируется и использование является некоммерческим. См.: http://creativecommons.org/licenses/by-nc/4.0/
Источник рукописи: приглашенная рукопись
Адрес для корреспонденции: Акбар Хан, доктор медицины, медицинский директор,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. akhan@medicorcancer.com
Телефон: +1-416-2270037
Факс: +1-416-2271915
Получено: 30 января 2017 г.
Начало рецензирования: 12 февраля 2017 г.
Первое решение: 28 марта 2017 г.
Исправлено: 5 мая 2017 г.
Принято: 30 мая 2017 г.
Статья в печати: 31 мая 2017 г.
Опубликовано онлайн: 10 августа 2017 г.
Абстрактный
Дихлорацетат натрия (DCA) изучается как метаболическая терапия рака с 2007 года на основе публикации Bonnet et al, демонстрирующей, что DCA может вызывать апоптоз (запрограммированную гибель клеток) в клетках рака молочной железы, легких и мозга человека. Классически реакция рака на медикаментозную терапию в исследованиях на людях измеряется с помощью определений Критериев оценки ответа для солидных опухолей, которые определяют «ответ» по степени уменьшения опухоли или исчезновения опухоли при визуализации, однако стабилизация заболевания также является полезным клиническим результатом. Было показано, что DCA может функционировать как цитостатический агент in vitro и in vivo, не вызывая апоптоза. Представлен случай 32-летнего мужчины, у которого терапия DCA без сопутствующей традиционной терапии привела к регрессии и стабилизации рецидивирующей метастатической меланомы в течение более 4 лет с незначительными побочными эффектами. Этот случай демонстрирует, что DCA можно использовать для уменьшения объема заболевания и поддержания долгосрочной стабильности у пациентов с запущенной меланомой.
Ключевые слова: Дихлорацетат; Рак; BRAF; Меланома; Цитостатики
© Автор(ы) 2017. Опубликовано Baishideng Publishing Group Inc. Все права защищены.
Основная подсказка: Дихлорацетат натрия (DCA) изучается как метаболическая терапия рака с 2007 года. Было показано, что терапия DCA может привести к классическому ответу, который измеряется уменьшением или исчезновением опухолей при визуализации. Однако DCA может также остановить рост раковых клеток, не вызывая апоптоза (цитостатический эффект). Это может привести к долгосрочной стабилизации метастатического рака. Мы представляем случай пероральной терапии DCA, которая привела к уменьшению и стабилизации метастатической меланомы у 32-летнего мужчины в течение более 4 лет, с небольшими побочными эффектами.
Хан А., Эндрюс Д., Шейнхаус Дж., Блэкберн А.К. Долгосрочная стабилизация метастатической меланомы с помощью дихлорацетата натрия.
World J Clin Oncol 2017; 8(4): 371-377
Доступно по адресу: URL: http://www.wjgnet.com/2218-4333/full/v8/i4/371.htm
DOI: http://dx.doi.org/10.5306/wjco.v8.i4.371
ВВЕДЕНИЕ
Дихлорацетат натрия (DCA) привлек внимание медицинского сообщества в 2007 году, когда Боннет и др. опубликовали первое исследование in vitro и in vivo, иллюстрирующее ценность DCA как метаболической терапии рака посредством его ингибирующего действия на митохондриальный фермент пируватдегидрогеназу киназу. Ранее Стакпул и др. опубликовали несколько исследований DCA для лечения врожденного лактатацидоза при митохондриальных заболеваниях. Эти исследования показали, что пероральный DCA является безопасным препаратом для использования человеком. Было отмечено, что DCA не оказывает почечной, легочной, костномозговой и сердечной токсичности . Большинство побочных эффектов DCA были умеренными, причем наиболее серьезным из них была обратимая периферическая невропатия . Также сообщалось об обратимом делирии. Повышение уровня печеночных ферментов (бессимптомное и обратимое) было отмечено у небольшого процента пациентов. Предшествующие исследования митохондриальных расстройств на людях позволили быстро перевести DCA на использование человеком в качестве не по назначению терапии рака. В настоящее время опубликовано несколько отчетов о клинических испытаниях с использованием DCA в качестве терапии рака, подтверждающих его профиль безопасности и указывающих на растущее признание потенциальной полезности DCA в онкологической клинике . Одним из ограничений этих исследований с участием пациентов на поздней стадии является то, что они сообщали только о лечении в течение коротких периодов времени.
В публикации Бонне 2007 года было показано, что лечение DCA снижает потенциал митохондриальной мембраны, что селективно способствует апоптозу в раковых клетках человека. Ингибирование аэробного гликолиза (эффект Варбурга) и активация митохондриальных калиевых ионных каналов были идентифицированы как механизмы действия DCA. Дальнейшие исследования DCA in vitro подтвердили противораковую активность против широкого спектра типов рака, которые были недавно рассмотрены Канкотией и Стэкпулом . Кроме того, DCA также способен усиливать апоптоз в сочетании с другими агентами . Также были предложены другие противораковые действия DCA, включая ингибирование ангиогенеза , изменение экспрессии HIF1-α , изменение регуляторов pH клеток V-АТФазы и MCT1, а также других регуляторов выживания клеток, таких как p53 и PUMA . Однако во многих исследованиях in vitro используются неоправданно высокие концентрации DCA, которые клинически недостижимы, в попытке продемонстрировать цитотоксическую активность.. В других исследованиях использовались более скромные концентрации DCA, что показало, что DCA может быть цитостатическим. Во втором отчете 2010 года о его противораковой активности in vivo было обнаружено, что DCA сам по себе является цитостатическим в метастатической модели рака молочной железы , ингибируя пролиферацию, не вызывая апоптоз. Это предполагает роль DCA как стабилизатора рака, аналогичного ингибиторам ангиогенеза.
В ответ на отчет 2007 года о противораковом действии DCA Хан начал использовать DCA для лечения онкологических больных с коротким прогнозом или тех, кто перестал реагировать на традиционные методы лечения рака. В сотрудничестве с врачом-натуропатом (Эндрюс) был разработан протокол натурального лечения для решения проблемы ограничивающей дозу неврологической токсичности DCA. Он состоял из 3 лекарств: ацетил L-карнитин , R-альфа-липоевая кислота и бенфотиамин для профилактики нейропатии и энцефалопатии. У более чем 300 пациентов с поздней стадией рака наблюдательные данные показали, что терапия DCA принесла пользу в 60% -70% случаев. Риск нейропатии при сочетании натуральных нейропротекторных лекарств с DCA составлял приблизительно 20% при дозировке 20-25 мг/кг в день в течение 2 недель приема/1 недели перерыва (клинические наблюдательные данные опубликованы онлайн на сайте www.medicorcancer.com). Здесь представлен отчет о случае пациента, иллюстрирующий как апоптотический, так и антипролиферативный эффект хронического лечения DCA в течение более четырех лет.
ОТЧЕТ О ДЕЛЕ
32-летний ранее здоровый светлокожий мужчина изначально заметил, что родинка на его левой икре начала меняться в 2006 году. Он обратился к врачу, и родинка была удалена. Был поставлен патологический диагноз меланомы. Была проведена диссекция сторожевого узла, которая оказалась отрицательной на метастатическое заболевание. В 2007 году пациент отметил увеличение левых паховых лимфатических узлов и небольшие меланоцитарные поражения на коже левой ноги. Он прошел лечение интерфероном альфа в рамках клинического испытания в региональной онкологической больнице, что привело к уменьшению узлов и разрешению кожных метастазов. Интерферон был отменен через 9 месяцев из-за побочных эффектов.
Пациент оставался в хорошем состоянии до 2010 года, когда появился новый кожный метастаз левой ноги. Он был хирургически удален. В конце 2011 года был обнаружен еще один новый кожный метастаз на левой ноге в рубце от первоначальной операции по удалению меланомы. Была проведена биопсия, и был подтвержден диагноз рецидивирующей меланомы. Затем ему сделали широкое иссечение и пересадку кожи.
В марте 2012 года у пациента диагностировали рецидив в кожном лоскуте левой ноги. Он был иссечен, и была проведена новая процедура пересадки кожи. Патология выявила положительные края иссеченного метастаза, поэтому была проведена повторная резекция, снова с положительными краями. В то же время игольчатая биопсия левого пахового лимфатического узла подтвердила наличие BRAF-положительной метастатической меланомы. Компьютерная томография (КТ), проведенная в марте 2012 года, не выявила никаких признаков отдаленных метастазов. Самый большой левый паховый узел имел диаметр 8 мм, что было сообщено как «незначительный по критериям размера» (рисунок 1).
В апреле 2012 года пациент обратился к врачу-натуропату (Shainhouse) и начал терапию следующими пероральными натуральными противораковыми средствами: активное гексозо-коррелированное соединение или AHCC (экстракт гриба) , корень одуванчика , куркумин и корень астрагала . Также была начата парентеральная терапия, которая состояла из внутривенного витамина С два раза в неделю и подкожного экстракта омелы европейской. Пациент также перешел на веганскую диету.
В мае 2012 года пациент посетил клинику автора (Khan), желая получить дополнительные нетрадиционные методы лечения. Обсуждалась терапия DCA, но пациент решил сначала провести адекватную пробу натуральных противораковых методов лечения (прописанных Shainhouse). В мае 2012 года была проведена повторная КТ (всего через 1 месяц естественной терапии), которая выявила умеренное увеличение множественных паховых и наружных подвздошных узлов размерами от 10 мм × 11 мм до 14 мм × 15 мм.
В июле 2012 года КТ-сканирование было повторено для оценки естественной противораковой терапии пациента. В то время левые паховые и наружные подвздошные узлы снова увеличились и имели размер от 13 мм × 16 мм до 22 мм × 20 мм (рисунок 2). ПЭТ-сканирование также было проведено в рамках подготовки к участию в клиническом исследовании в Бостоне, штат Массачусетс (США), и подтвердило повышенное поглощение глюкозы в левых паховых узлах. Появилась новая слабая (2/10) ноющая боль в левой паховой области. Обследование выявило 20-миллиметровый безболезненный левый паховый лимфатический узел и два небольших кожные метастаза в пределах кожного трансплантата левой голени.
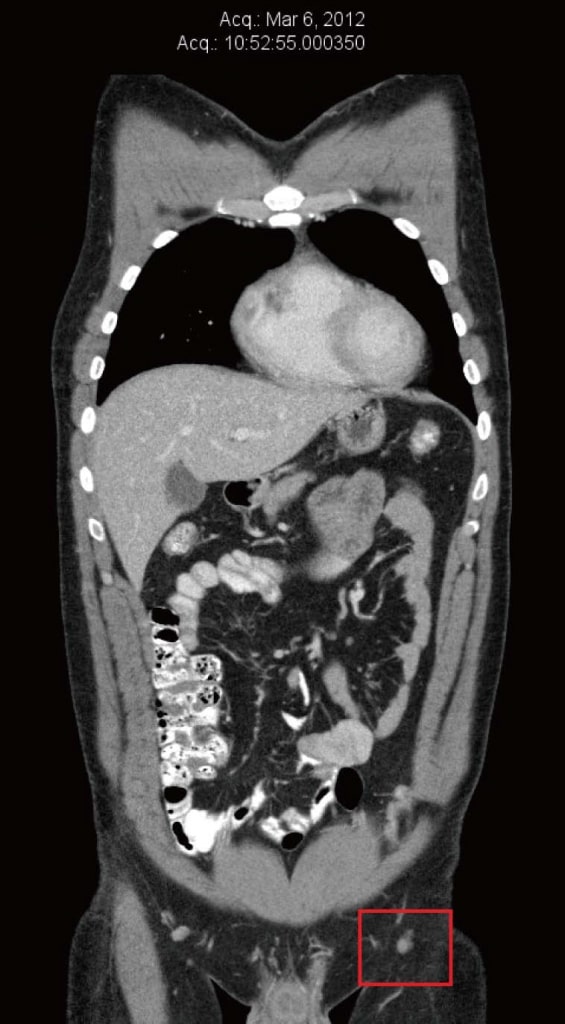 Рисунок 1. Компьютерная томография от марта 2012 г. до естественной терапии и до терапии дихлорацетатом. Самый большой узел имел диаметр 8 мм.
Рисунок 1. Компьютерная томография от марта 2012 г. до естественной терапии и до терапии дихлорацетатом. Самый большой узел имел диаметр 8 мм.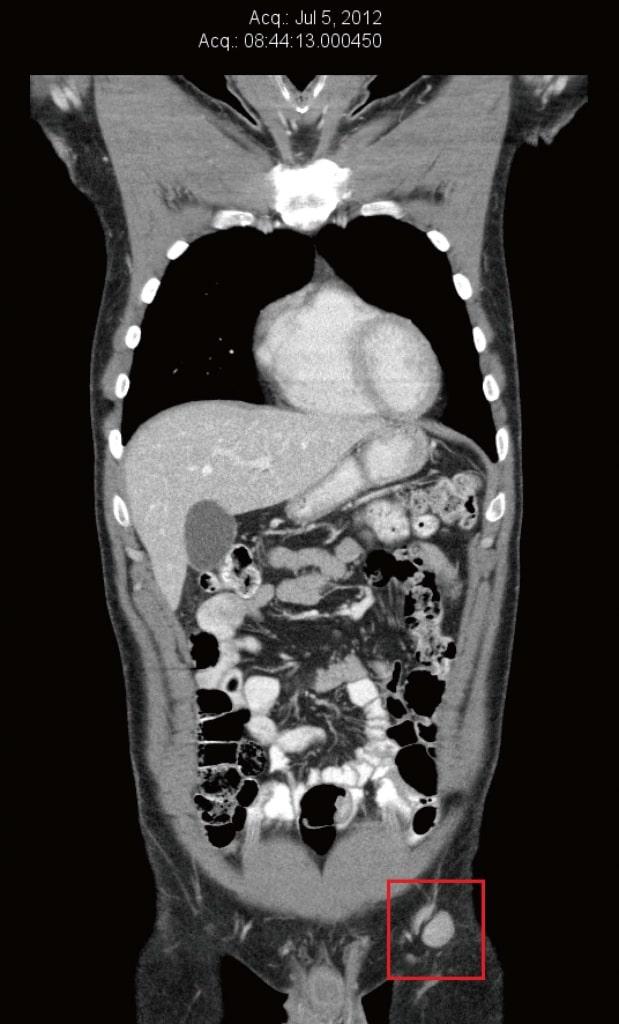 Рисунок 2. Компьютерная томография от июля 2012 г. после 3 месяцев только естественной терапии, непосредственно перед началом терапии дихлорацетатом. Самый большой узел имел размеры 22 мм × 20 мм.
Рисунок 2. Компьютерная томография от июля 2012 г. после 3 месяцев только естественной терапии, непосредственно перед началом терапии дихлорацетатом. Самый большой узел имел размеры 22 мм × 20 мм.
Таким образом, у пациента диагностировали прогрессирование заболевания. В этот момент он решил начать терапию DCA. Он начал принимать DCA перорально по 500 мг 3 раза в день, что было эквивалентно 17 мг/кг в день (производитель: Tokyo Chemical Industry, США) в дополнение к поддержанию других натуральных методов лечения. Цикл лечения DCA составлял 2 недели приема и 1 неделю перерыва. Чтобы свести к минимуму возникновение побочных эффектов DCA, были назначены 3 дополнительных натуральных препарата: пероральный ацетил L-карнитин по 500 мг 3 раза в день, пероральный бенфотиамин по 80 мг два раза в день и пероральная R-альфа-липоевая кислота по 150 мг 3 раза в день. Эти добавки принимались ежедневно (без цикла). Были проведены рутинные базовые анализы крови (таблица 1). Все они были в норме, за исключением низкого уровня креатинина, который считался незначительным.
В ноябре 2012 года, через 4 месяца после добавления DCA к его первоначальной естественной противораковой терапии, пациент прошел повторную оценку. Он чувствовал себя в целом хорошо. Было сообщено, что два новых симптома начались только после начала терапии DCA: слегка сниженная чувствительность кончиков пальцев рук и ног и слегка сниженная способность концентрироваться в течение 2 недель, в течение которых он принимал DCA. Легкая потеря чувствительности не ухудшалась и ощущалась как легкая невропатия, связанная с DCA. Сообщалось, что как онемение, так и снижение концентрации прошли в течение недель, когда пациент не принимал DCA. Анализ крови от октября 2012 года не показал существенных изменений (таблица 1). КТ в августе 2012 года и ноябре 2012 года выявили значительную регрессию всех ранее увеличенных лимфатических узлов. Самый большой узел был 10 мм, и не было никаких признаков внутригрудного или внутрибрюшного заболевания, а также никаких метастазов в кости (рисунок 3).
Пациент продолжал чувствовать себя хорошо на терапии DCA и не заметил никаких новых метастазов в коже или нового увеличения паховых узлов. Он продолжал проходить частый клинический мониторинг у своего врача-натуропата (Шейнхаус) и ежегодное последующее наблюдение у своего лечащего врача (Хан). Перечисленные натуральные противораковые терапии (назначенные Шейнхаусом) и терапия DCA продолжались до 2016 года. Результаты анализа крови в июне 2016 года продолжали быть нормальными (таблица 1). КТ была повторена в августе 2016 года, не показав никаких признаков метастатической меланомы, после полных 4 лет непрерывной терапии DCA в сочетании с натуральной противораковой терапией (рисунок 4). К декабрю 2016 года пациент сообщил об увеличении стресса, связанного с работой, и снижении соблюдения режима приема лекарств. В то время он заметил новую паховую массу слева. Была получена ультразвуковая визуализация, которая выявила новый конгломерат увеличенных лимфатических узлов размером 40 мм × 25 мм × 23 мм, с цветным допплером, показывающим кровоток внутри массы. Это было интерпретировано как повторный рост меланомы, примерно после четырех с половиной лет непрерывной терапии DCA. Было проведено дальнейшее обследование, включая ПЭТ/КТ, которое подтвердило рецидив заболевания в 3 левых паховых узлах (SUV max в диапазоне от 13 до 17,8).
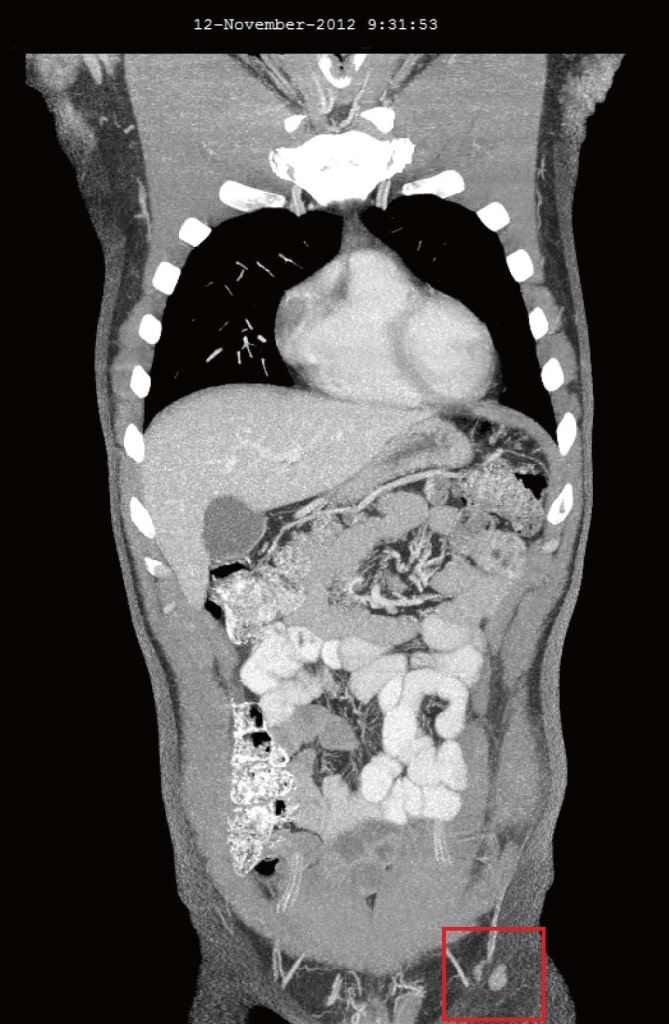 Рисунок 3. Компьютерная томография от ноября 2012 г. после 4 месяцев терапии дихлорацетатом. Самый большой узел размером 10 мм.
Рисунок 3. Компьютерная томография от ноября 2012 г. после 4 месяцев терапии дихлорацетатом. Самый большой узел размером 10 мм.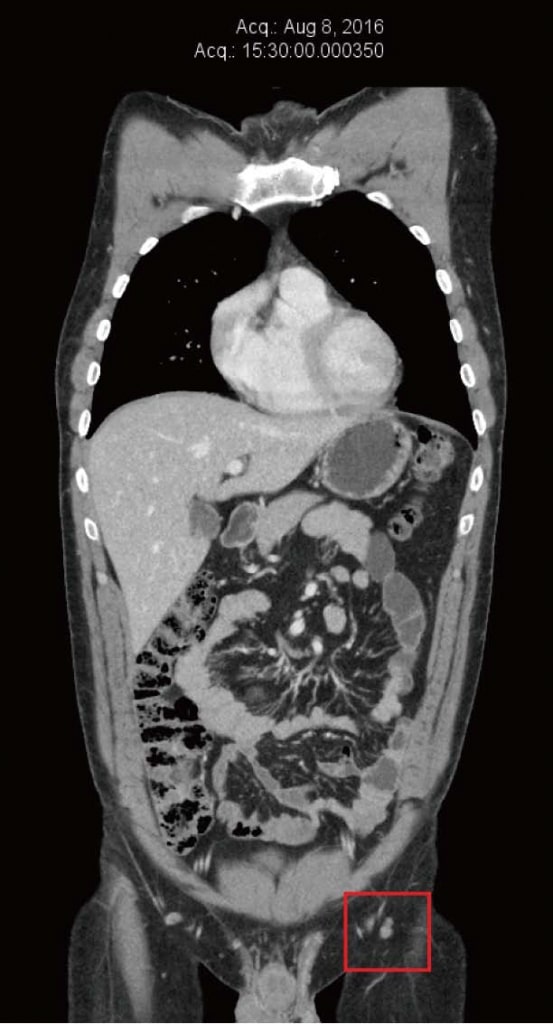 Рисунок 4. Компьютерная томография после 4 лет терапии дихлорацетатом без сопутствующих традиционных методов лечения рака. Сканирование показывает отсутствие повторного роста рака. Все узлы имеют размер менее 10 мм.
Рисунок 4. Компьютерная томография после 4 лет терапии дихлорацетатом без сопутствующих традиционных методов лечения рака. Сканирование показывает отсутствие повторного роста рака. Все узлы имеют размер менее 10 мм.
Вкратце, пациент получал традиционную терапию рецидивирующей меланомы 3 стадии в течение 6 лет, состоящую из первичной хирургической резекции с лимфодиссекцией, интерферона альфа и хирургической резекции рецидивирующих кожных метастазов 5 раз. Затем пациент получал только естественную противораковую терапию (назначенную Шейнхаусом) в течение 3 месяцев без ответа, о чем свидетельствовало устойчивое прогрессирование заболевания на серийных КТ-сканированиях. Наконец, пациент добавил пероральную терапию DCA к естественной противораковой терапии с 3 сопутствующими нейропротекторными препаратами (липоевая кислота, ацетил L-карнитин и бенфотиамин) и без сопутствующих традиционных методов лечения рака. Результатом стала полная радиологическая ремиссия, продолжавшаяся более 4 лет, за которой последовал рецидив. Во время курса терапии DCA у пациента наблюдались незначительные побочные эффекты, состоящие из легкой невропатии и небольшого снижения концентрации. У пациента сохранялась функция ECOG уровня 0, и он мог работать полный рабочий день.
Таблица 1 Анализ крови до терапии дихлорацетатом натрия
| Анализ крови | 12 июля до DCA | 12 октября 3 мес. DCA | 16 июня 4 года DCA | Единицы | Нормальный диапазон |
|---|---|---|---|---|---|
| Гемоглобин | 154 | 150 | 157 | г/л | 135-175 |
| Количество лейкоцитов | 4.5 | 4.1 | 5 | × 10 9 /л | 4.0-11.0 |
| Тромбоциты | 220 | 214 | 229 | × 10 9 /л | 150-400 |
| Глюкоза | – | 4.6 | 4.9 | ммоль/л | 3.6-7.7 |
| Мочевина | 3.9 | 3.2 | 3.9 | ммоль/л | 2,5-8,0 |
| Креатинин | 49 1 | 50 1 | 55 1 | мкмоль/л | 62-115 |
| Кальций | 2.47 | 2.41 | 2.47 | ммоль/л | 2.15-2.60 |
| Альбумин | 48 | 45 | 47 | г/л | 35-50 |
| Билирубин | 8 | 10 | 13 | мкмоль/л | < 22 |
| Натрий | 139 | 141 | 140 | ммоль/л | 135-147 |
| Калий | 4 | 4.3 | 3.9 | ммоль/л | 3,5-5,5 |
| Хлористый | 106 | 107 | 105 | ммоль/л | 100-110 |
| Щелочная фосфатаза | 77 | 69 | 71 | У/л | 45-129 |
| ЛДГ | 139 | 135 | 144 | У/л | 120-246 |
| ГГТ | 18 | 19 | 20 | У/л | 15-73 |
| АСТ | 18 | 25 | 21 | У/л | 7-37 |
| АЛЬТ | 18 | 28 | 19 | У/л | 12-49 |
1 Указывает на аномальное значение. DCA: Дихлорацетат; LDH: Лактатдегидрогеназа; GGT: Гамма-глутамилтрансфераза; AST: Аспартатаминотрансфераза; ALT: Аланинаминотрансфераза.
ОБСУЖДЕНИЕ
Использование перорального DCA у пациента с метастатической меланомой, описанное здесь, демонстрирует уменьшение опухоли и долгосрочную стабильность заболевания в соответствии с клиническим статусом и КТ-визуализацией. Стабильность заболевания сохранялась более 4 лет при приеме DCA в отсутствие какой-либо сопутствующей традиционной терапии, с выживаемостью с момента первоначальной постановки диагноза 10 лет. Согласно статистике рака SEER Национального института рака, выживаемость этого пациента, у которого не было признаков отдаленных метастазов, не является примечательной (62,9% 5-летняя выживаемость при меланоме с распространением на региональные лимфатические узлы, https://seer.cancer.gov/statfacts/html/melan.html). Примечательно то, что в ситуации, когда вовлеченные лимфатические узлы явно увеличивались, добавление пероральной терапии DCA было эффективным для уменьшения увеличивающихся узлов (рисунки 2 и 3) и достижения ремиссии, продолжавшейся более 4 лет. Возможно, что естественные противораковые терапии, которые получал пациент, синергизировались с DCA, но также очевидно, что эти естественные терапии сами по себе не могут объяснить регрессию заболевания. Сообщалось, что DCA оказывает как апоптотический, так и цитостатический эффект, что согласуется с клиническим течением регрессии (апоптотический) и длительной ремиссией (цитостатический) у этого пациента. Рецидив через 4 года совпал с уменьшением соблюдения режима лечения, что предполагает, что этот метод лечения рака с помощью DCA требует постоянного поддержания метаболического давления. Несмотря на рецидив, пациент оставался клинически здоровым и планировал начать прием новых иммунотерапевтических препаратов. Еще предстоит выяснить, сможет ли изменение терапии снова достичь регрессии или стабильности заболевания.
Помимо поддержания ремиссии в течение более 4 лет, этот случай иллюстрирует, что DCA может хорошо переноситься онкологическим пациентом в течение длительного периода времени по сравнению со всеми опубликованными клиническими испытаниями DCA по раку. Примечательно, что этот пациент смог переносить 17 мг/кг в день в режиме 2 недели приема/1 неделя перерыва в течение 4 лет с минимальными побочными эффектами. Это похоже на наш предыдущий отчет о случае хронического использования DCA при раке толстой кишки , где пациент смог переносить 16 мг/кг в день (но не 25 мг/кг в день) в том же режиме, но контрастирует с клиническими испытаниями DCA, которые рекомендуют более низкую дозу 10-12,5 мг/кг в день, вводимую непрерывно. Перерыв в 1 неделю или нейропротекторные добавки могут способствовать способности пациентов в отчетах о случаях переносить более высокую дозу. Генетические полиморфизмы в GSTZ1, ферменте печени, который метаболизирует DCA, также могут способствовать дозе DCA, которая может быть переносима. В испытаниях сообщалось о различных уровнях препарата, но не все из них рассматривали этот фармакогенетический аспект терапии DCA , и необходимы дальнейшие исследования, чтобы выяснить, является ли это существенным фактором переносимости DCA. На момент написания этой статьи продолжается исследование DCA с множественной миеломой у людей, в котором изучаются как генотипы GSTZ1, так и уровни препарата, чтобы внести свой вклад в наше понимание этих проблем (Реестр клинических испытаний Австралии и Новой Зеландии #ACTRN12615000226505, http://www.anzctr.org.au).
Этот отчет о случае показывает, что хроническая терапия DCA может использоваться без снижения качества жизни по сравнению с традиционными методами лечения меланомы, такими как интерферон. Чтобы определить оптимальный протокол для максимально переносимого острого или хронического лечения с помощью DCA, необходимы испытания на людях. Но что еще важнее, все еще остается выяснить, какая доза требуется для целевых эффектов, которые будут эффективны против рака. Эта информация необходима перед инвестированием в более крупные долгосрочные исследования результатов для пациентов. DCA заслуживает дальнейшего изучения в клинических испытаниях как нетоксичная терапия рака из-за своей скромной стоимости и низкой токсичности, а также заслуживает рассмотрения в качестве терапии рака не по назначению.
БЛАГОДАРНОСТИ
Авторы хотели бы поблагодарить доктора Хумайру Хан за ее помощь, а также пациентку за ее поддержку и согласие опубликовать ее случай.
КОММЕНТАРИИ
Характеристика случая
У 32-летнего мужчины на ноге обнаружилось пигментное пятно.
Клинический диагноз
У пациентки диагностирована меланома.
Лабораторный диагноз:
Меланома подтверждена эксцизионной биопсией.
Диагностика с помощью визуализации:
подтверждено наличие увеличенного пахового узла в меланоме (биопсия иглой).
Патологический диагноз:
Меланома, BRAF-положительный.
Лечение
Иссечение первичного очага с пересадкой кожи, иссечение сторожевого узла, множественные иссечение рецидивирующих кожных метастазов. Традиционная терапия прекращена и начаты натуральные противораковые терапии (AHCC, корень одуванчика, куркумин, корень астрагала, внутривенно витамин С, подкожно европейская омела). Прогрессирование через 3 месяца, добавлен дихлорацетат (DCA). Регресс и ремиссия после добавления DCA, продолжающиеся более 4 лет.
Сопутствующие отчеты
Отчеты компьютерной томографии демонстрируют течение заболевания и реакцию на терапию.
Объяснение термина
DCA: Дихлорацетат натрия; RECIST: Критерии оценки ответа на солидные опухоли; ECOG: Восточная кооперативная онкологическая группа; SEER: Наблюдение, эпидемиология и конечные результаты.
Опыт и уроки
DCA может действовать как проапоптотический и цитостатический препарат и, таким образом, может достигать регрессии, а также долгосрочной стабилизации метастатического рака без серьезных побочных эффектов, как показано на примере этого случая меланомы.
Рецензирование
Доктор Хан описал 32-летнего мужчину, который получал терапию DCA с другими препаратами от натуропатов и поддерживался в состоянии стабилизации (метастатическая меланома) более 4 лет. Это интересный случай.
ССЫЛКИ
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. Ось митохондриального канала K+ подавляется при раке, а ее нормализация способствует апоптозу и подавляет рост рака. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/ j.ccr.2006.10.020]
2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Роль дихлорацетата в лечении генетических митохондриальных заболеваний. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Оценка длительного лечения детей с врожденным лактоацидозом дихлорацетатом. Педиатрия 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/ peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O'Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Контролируемое клиническое исследование дихлорацетата для лечения врожденного лактоацидоза у детей. Педиатрия 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Терапевтический потенциал дихлорацетата при дефиците пируватдегидрогеназного комплекса. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Дихлорацетат вызывает токсическую невропатию при MELAS: рандомизированное контролируемое клиническое исследование. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Тяжелая энцефалопатия и полинейропатия, вызванная дихлорацетатом. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Микелакис Э.Д., Сутендра Г., Дромпарис П., Вебстер Л., Хароми А., Нивен Э., Магуайр К., Гаммер Т.Л., Макки Дж.Р., Фултон Д., Абдулкарим Б., Макмертри М.С., Петрук К.С. Метаболическая модуляция глиобластомы дихлорацетатом. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Данбар EM, Коутс BS, Шроудс AL, Лангаи T, Лью A, Фордер JR, Шустер JJ, Вагнер DA, Стэкпул PW. Фаза 1 испытания дихлорацетата (DCA) у взрослых с рецидивирующими злокачественными опухолями мозга. Invest New Drugs2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/ s10637-013-0047-4]
10Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Дихлорацетат следует рассматривать с химиотерапией на основе платины при гипоксических опухолях, а не как единственный агент при распространенном немелкоклеточном раке легких. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Открытое исследование фазы I с однокомпонентным методом и повышением дозы дихлорацетата (DCA) у пациентов с запущенными солидными опухолями. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Канкотия С., Стэкпул П. У. Дихлорацетат и рак: новый дом для орфанного препарата? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
13 Сан Р. К., Борд П. Г., Блэкберн А. К. Нацеливание метаболизма с помощью триоксида мышьяка и дихлорацетата в клетках рака молочной железы. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
14 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Дихлорацетат натрия селективно воздействует на клетки с дефектами в митохондриальной ЭТЦ. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
15 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Нацеливание на два аспекта метаболизма при лечении рака молочной железы. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
16 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Активация митохондрий путем ингибирования PDKII подавляет сигнализацию HIF1a и ангиогенез при раке. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
17 Cairns RA, Bennewith KL, Graves EE, Giaccia AJ, Chang DT, Denko NC. Фармакологически повышенная гипоксия опухоли может быть измерена с помощью позитронно-эмиссионной томографии с 18F-фторазомицин арабинозидом и усиливает реакцию опухоли на гипоксический цитотоксин PR-104. Clin Cancer Res 2009; 15: 7170-7174 [PMID: 19920111 DOI: 10.1158/1078-0432.CCR-09-1676]
18 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro эффекты дихлорацетата и CO2 на гипоксические клетки HeLa. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
19 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Изменение гликолитического фенотипа дихлорацетатом подавляет рост метастатических клеток рака молочной железы in vitro и in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/ s10549-009-0435-9]
20De Grandis D. Ацетил-L-карнитин для лечения периферической нейропатии, вызванной химиотерапией: краткий обзор. CNS Drugs 2007; 21 Suppl 1: 39-43; обсуждение 45-46 [PMID: 17696592]
21 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. Пилотное исследование эффекта ацетил-L-карнитина при периферической нейропатии, вызванной паклитакселом и цисплатином. Tumori 2005; 91: 135-138 [PMID: 15948540]
22 Evans JD, Jacobs TF, Evans EW. Роль ацетил-L-карнитина в лечении диабетической периферической нейропатии. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
23 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Альфа-липоевая кислота при симптоматической периферической нейропатии у пациентов с диабетом: метаанализ рандомизированных контролируемых исследований. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
24 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. [Лечебный эффект альфа-липоевой кислоты на периферическую нейропатию при диабете 2 типа: клиническое исследование]. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
25 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Лечение симптоматической диабетической периферической нейропатии антиоксидантной альфа-липоевой кислотой. 3-недельное многоцентровое рандомизированное контролируемое исследование (исследование ALADIN). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
26 Winkler G, Kempler P. [Патомеханизм диабетической нейропатии: предпосылки патогенез-ориентированной терапии]. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
27 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Витамин B для лечения периферической нейропатии. Cochrane Database Syst Rev 2008; (3): CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573. pub3]
28 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Эффективность различных режимов дозировки бенфотиамина при лечении болезненной диабетической невропатии. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
29 Ignacio RM, Kim CS, Kim YD, Lee HM, Qi XF, Kim SK. Терапевтический эффект активного гексозо-коррелированного соединения (AHCC) в сочетании с CpG-ODN (олигодезоксинуклеотидом) в мышиной модели меланомы B16. Cytokine 2015; 76: 131-137 [PMID: 26082022 DOI: 10.1016/j.cyto.2015.06.002]
30 Chatterjee SJ, Ovadje P, Mousa M, Hamm C, Pandey S. Эффективность экстракта корня одуванчика в индукции апоптоза в клетках меланомы человека, устойчивых к лекарственным препаратам. Evid Based Complement Alternat Med 2011; 2011: 129045 [PMID: 21234313 DOI: 10.1155/2011/129045]
31Mirzaei H, Naseri G, Rezaee R, Mohammadi M, Banikazemi Z, Mirzaei HR, Salehi H, Peyvandi M, Pawelek JM, Sahebkar A. Куркумин: новый кандидат для терапии меланомы? Int J Cancer 2016; 139: 1683-1695 [PMID: 27280688 DOI: 10.1002/ijc.30224]
32 Huang XY, Zhang SZ, Wang WX. Повышение противоопухолевой эффективности при комбинированном применении астрагала и птеростильбена при меланоме. Asian Pac J Cancer Prev 2014; 15: 1163-1169 [PMID: 24606435]
33 Wagner SC, Markosian B, Ajili N, Dolan BR, Kim AJ, Alexandrescu DT, Dasanu CA, Minev B, Koropatnick J, Marincola FM, Riordan NH. Внутривенная аскорбиновая кислота как адъювант иммунотерапии интерлейкином-2. J Transl Med 2014; 12: 127 [PMID: 24884532 DOI:10.1186/1479-5876-12-127]
34 Horneber MA, Bueschel G, Huber R, Linde K, Rostock M. Терапия омелой в онкологии. Cochrane Database Syst Rev 2008; (2): CD003297 [PMID: 18425885 DOI: 10.1002/14651858.CD003297.pub2]
35 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Дихлорацетат влияет на пролиферацию, но не на выживаемость клеток колоректального рака человека. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
36 Abildgaard C, Dahl C, Basse AL, Ma T, Guldberg P. Биоэнергетическая модуляция с помощью дихлорацетата снижает рост клеток меланомы и усиливает их ответ на ингибирование BRAFV600E. J Transl Med 2014; 12: 247 [PMID: 25182332 DOI: 10.1186/s12967-014-0247-5]
37 Хан А., Эндрюс Д., Блэкберн А. С. Долгосрочная стабилизация рака толстой кишки 4 стадии с использованием терапии дихлорацетатом натрия. World J Clin Cases 2016; 4: 336-343 [PMID: 27803917]
38 Ценг Х. Ф., Блэкберн А. С., Борд П. Г., Андерс М. В. Полиморфизм и зависящая от вида инактивация дзета-глутатионтрансферазы дихлорацетатом. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]