преведено с английского SAID-lab.com
Амигдалин как перспективный противораковый агент:
молекулярный Механизмы и будущие перспективы развития Новые наноформулы для его доставки
Аннотация: Уровень заболеваемости раком растет, и рак является одной из основных причин смертности во всем мире. Амигдалин, также известный как витамин B17 (и лаэтрил, синтетическое соединение), представляет собой цианогенное гликозидное соединение, которое в основном содержится в ядрах и мякоти фруктов. Это соединение на протяжении десятилетий предлагалось как многообещающее природное вещество, которое может оказывать противораковое действие. Это всеобъемлющий обзор, в котором критически обобщаются и тщательно анализируются имеющиеся исследования, изучающие противораковый эффект амигдалина, подчеркиваются его потенциальные противораковые молекулярные механизмы, а также необходимость создания нетоксичной рецептуры этого вещества. Углубленное исследование проводилось с использованием наиболее точных научных баз данных, например, PubMed, Cochrane, Embase, Medline, Scopus и Web of Science, с применением эффективных, характерных и релевантных ключевых слов. Есть несколько доказательств, подтверждающих идею о том, что амигдалин может оказывать противораковое действие при раке легких, молочной железы, простаты, колоректального рака, рака шейки матки и желудочно-кишечного тракта. Сообщалось, что амигдалин индуцирует апоптоз раковых клеток, ингибируя пролиферацию раковых клеток и замедляя метастатическое распространение опухоли. Однако на моделях животных in vivo было проведено лишь несколько исследований , а клинические исследования остаются еще более скудными. Имеющиеся данные не могут поддержать рекомендации по использованию пищевых добавок с амигдалином из-за его цианогруппы, которая вызывает неблагоприятные побочные эффекты. Предварительные данные показали, что использование наночастиц может быть многообещающей альтернативой для усиления противоракового эффекта амигдалина при одновременном снижении его неблаго Амигдалин, по-видимому, является многообещающим природным агентом против развития и прогрессирования раковых заболеваний. Тем не менее, существует большая потребность в исследованиях на животных in vivo , а также клинических исследованиях на людях для изучения потенциальной эффективности профилактики и/или лечения амигдалина против рака. Более того, амигдалин можно использовать в качестве ведущего соединения, эффективно применяя последние разработки в процессах разработки лекарств.
- Введение
Характеристика глобальных изменений бремени болезней и тенденций с течением времени дает важную информацию об этиологии рака и служит основой для стратегий профилактики и лечения. Злокачественные новообразования считаются основной причиной смертности во всем мире; число новых случаев рака во всем мире достигло 19,3 миллиона, и в 2020 году умерло почти 10 миллионов человек [1]. Вызывают тревогу новые данные, согласно которым число новых случаев заболевания с 2020 по 2040 год во всем мире составит 28,4 миллиона человек [2]. Кроме того, самые последние данные Всемирной организации здравоохранения (ВОЗ) показывают, что рак молочной железы остается наиболее распространенным злокачественным заболеванием у женщин в 158 из 183 стран (86%) и основной причиной смертности от рака в 173 из 183 стран.
95%) [3]. По данным Глобальной статистики рака 2020 года (GLOBOCAN) второй наиболее распространенной причиной смертности от рака во всем мире и третьей по распространенности злокачественной опухолью с точки зрения диагностики является колоректальный рак [1,4]. Более того, текущие модели смертности и долгосрочные тенденции для основных типов рака в 47 странах мира, исключая Африку, показывают, что уровень заболеваемости раком, связанным с инфекциями, таким как рак шейки матки и рак желудка, и раком, связанным с курением, таким как рак легких и пищевода, увеличились примерно в 10 раз [5]. В Европейском Союзе (ЕС) общее прогнозируемое число смертей от рака в 2023 году оценивается в 1 261 990 (702 214 среди мужчин, 559 776 среди женщин) [6]. Общая смертность от рака в 2022 году оценивалась в 1 269 200 [7], при этом колоректальный рак и рак легких были ведущими причинами смертности от рака (>30%)в ЕС. В Греции число новых случаев в 2020 г. составило 64 530, а количество смертей — 33 166 [5–7]. В США число новых случаев рака в 2023 году составит примерно 1 958 310, или примерно 5 370 случаев в день [8]. В этом контексте следует отметить, что эти оценки случаев на 2023 г. основаны
на недавно доступных данных о заболеваемости до 2019 г. и не учитывают влияние пандемии COVID-19 на
Соответственно, прогноз смертности от рака в 2023 году основан на данных до 2020 года [8].
Темой, представляющей интерес, является роль амигдалина, также известного как витамин B17 или лаэтрил (его синтетическое соединение), в профилактике и/или совместном лечении рака. Несколько исследований продемонстрировали широкий спектр биологических свойств амигдалина, предполагая, что он может оказывать профилактическое или даже сопутствующее воздействие на рак шейки матки, молочной железы, простаты, легких и мочевого пузыря, что в основном можно объяснить ингибированием рака. пролиферация клеток [9–13]. Как in vitro , так и in vivo оценки биологического действия экстрактов амигдалина из трех сортов маниоки (Manihot esculenta), выращенных в Бенине, продемонстрировали, что эта встречающаяся в природе молекула может эффективно действовать в профилактике рака и совместном лечении, подавляя образование раковых клеток [14]. ]. Исследования in vitro задокументировали индукцию апоптоза амигдалином из-за увеличения экспрессии белка Bax и каспазы-3 и снижения экспрессии антиапоптотического белка Bcl-2 [15,16]. В области химиопрофилактического потенциала амигдалина Erikel et al. (2023) отметили, что амигдалин может оказывать модулирующее действие на химиотерапевтические агенты, которые, по-видимому, вызывают геномные повреждения лимфоцитов человека [17].
Основные противораковые молекулярные механизмы амигдалина в основном связаны с ингибированием клеточного цикла, индукцией апоптоза, стимуляцией цитотоксического эффекта и регуляцией иммунной функции в организме человека [15,18,19]. Более того, основным молекулярным механизмом апоптоза является активация протеазы каспазы-3, которая инициируется клеточной репликацией белка Bax цитохрома С [20]. Высокая экспрессия проапоптотического белка Bax связана с апоптозом и последующей пролиферацией клеток [ 21]. В связи с этим считается, что амигдалин индуцирует апоптоз за счет увеличения активности каспазы-3 в клетках HeLa и подавления Bcl-2 [22]. Параллельно выяснилось, что Bax активируется в клетках HeLa, обработанных амигдалином, что позволяет предположить, что в апоптозе может быть задействован эндогенный путь [22]. Несколько линий клеток человека, в том числе раковых клеток легких, молочной железы, толстой кишки, яичек, предстательной железы, прямой кишки и мочевого пузыря, показали, что амигдалин может вызывать апоптоз и остановку клеточного цикла [19,20,22–26].
Несмотря на многообещающие результаты имеющихся в настоящее время исследований по изучению противораковых
эффектов амигдалина, существует большая потребность в дальнейших исследованиях по этой теме. На сегодняшний день Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) не одобрило медицинское использование амигдалина.
при одновременном лечении рака или других заболеваний в США, поскольку отсутствия адекватных данных об эффективности амигдалина и риске потенциального
неблагоприятные побочные эффекты [27,28]. В связи с этим целью настоящего обзора было критически обобщить и тщательно изучить имеющиеся данные о потенциальных противораковых эффектах амигдалина, подчеркивая его противораковые молекулярные механизмы и его возможное будущее применение в клинической практике борьбы с раком.
- Методы
Всесторонний и углубленный обзор был проведен с использованием наиболее точных научных баз данных, например, PubMed, Scopus, Web of Science и Google Scholar, с применением
эффективные, характерные и релевантные ключевые слова, такие как «амигдалин» или «лаэтрил» или «витамин B17» и «токсичность», «противоопухолевые эффекты» и/или «рак» и «молекулярные механизмы».
Критериями включения были исследования, написанные на английском языке, клинические исследования на людях,
исследования на животных in vitro и in vivo , а также рандомизированные клинические исследования (РКИ). Серая литература,
комментарии, редакционные статьи, письма в редакцию, рецензии, тезисы в материалах конференций,
а статьи в нерецензируемых журналах были исключены из окончательного анализа.
поиск был дополнен сканированием списков литературы соответствующих исследований и ручным
поиск ключевых журналов, комментариев, редакционных статей и тезисов в материалах конференций . Полученные опросы были дополнительно тщательно проверены на предмет наличия соответствующих исследований.
цитируются в их тексте.
Все авторы выступали в качестве рецензентов. Чтобы повысить согласованность действий рецензентов, все рецензенты
проверил все полученные публикации, обсудил результаты и внес изменения в процедуру проверки и
руководство по извлечению данных перед началом проверки для этого обзора. Все рецензенты работали в парах последовательно оценить названия, аннотации, а затем полные тексты всех публикаций
выявленные в ходе поиска потенциально релевантных публикаций. Мы разрешили разногласия по
отбор исследований и извлечение данных путем консенсуса и обсуждения со всеми авторами/рецензентами,
если нужно. Форма диаграммы данных была совместно разработана двумя рецензентами (MS и CG) для
определить, какие переменные следует извлечь. Два рецензента независимо друг от друга составили диаграммы данных.
обсуждали результаты и постоянно обновляли форму диаграммы данных в рамках итеративного процесса.
- Результаты
3.1. Амигдалин: основная информация и свойства
Амигдалин был открыт в 1803 году Шрейдером при исследовании ингредиентов горького миндаля.
и был впервые выделен в 1830 году двумя французскими химиками, Пьером-Жаном Робике и Антуаном.
Франсуа Бутрон-Шарлар [29,30]. Химики Хауорт и Уайлам наконец определились.
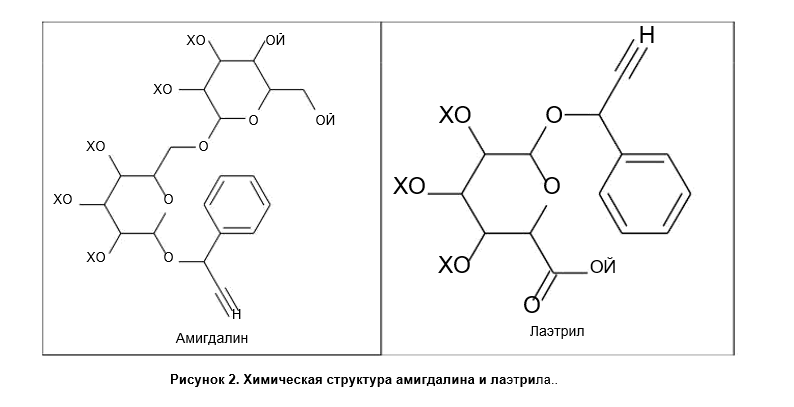
его точная химическая структура в 1923 году (рис. 2) [31]. Амигдалин (d-манделонитрил-β-d- глюкозид-6-β-глюкозид) представляет собой цианогенное гликозидное соединение, состоящее из дибензальдегида , синильной кислоты и двух молекул глюкозы (D-манделонитрил-β-D-глюкозид- 6 -глюкозид). β-глюкозид) [32]. Его биоактивная форма (D-манделонитрил-β-глюкоза) была использована в
Патент штата (USP). Лаэтрил — частично искусственная, синтетическая форма природного вещества.
амигдалин (рис. 2) [32]. В Мексике структура была дифференцирована и определена как D- манделонитрил-β-гентиобиозид [33]. Национальный центральный институт США (NCI) продемонстрировал
что мексиканская форма амигдалина (пероральная и внутривенная) не соответствует требованиям препарата США. стандартам, и это вещество было запрещено для потребления человеком [33]. Амигдалин в основном содержится в ядрах и мякоти таких фруктов, как сливы, абрикосовые косточки, черешня, персики.
Цитотоксический эффект амигдалина на раковые клетки in vitro и распределение амигдалина в растениях, которые
Содержаниеобычнопотребляютсяамигдалинаврационеврастенияхчеловека,являются,которыедвумяобычноизних.употребляются в пищу человеком, являются
наиболеедвумянаиболееинтересныеинтереснымитемыпоследнихтемамиисследованийнедавнихиссле.Однакоованийэто. Однаконеновоеэтосоединениеновое,соединениеоновеками, и оно имеет использовалось в традиционной и альтернативной медицине из-за его противораковых и противораковых свойств. использовался в традиционной и альтернативной медицине на протяжении веков благодаря своим противораковым
противовоспалительнымьныесвойствам и, в целом,,многочисленнымегомногочисленныемедицинскицинскиемпреимуществампреимущества[35,36,38][35,36,38].Это.
Это помогло облегчить боль и лихорадку; подавление кашля, жажды и тошноты; и в качестве
помог облегчить боль и лихорадку; подавление кашля, жажды и тошноты; и средство для профилактики
- сопутствующего лечения рака в последние годы [39,40].
- качестве средства профилактики и сопутствующего лечения рака в последние годы [39,40].
3.2. Противораковые эффекты и молекулярные механизмы амигдалина: данные in vitro и in vivo
3.2. Противораковые эффекты и молекулярные механизмы амигдалина: данные in vitro и in vivo
На сегодняшний день в нескольких исследованиях изучались потенциальные противораковые эффекты амигдалина.
На сегодняшний день несколько исследований изучили потенциальные противораковые эффекты амигдалина,
подчеркнув его противораковые молекулярные механизмы, особенно в легких, молочной железе, предстательной железе,
подчеркивая его противораковые молекулярные механизмы, особенно при раке легких, молочной железы, предстательной
железы, колоректального рака, рака шейки матки и желудочно-кишечного тракта. Потенциальные противораковые эффекты и
рак прямой кишки, шейки матки и желудочно-кишечного тракта. Потенциальные противораковые
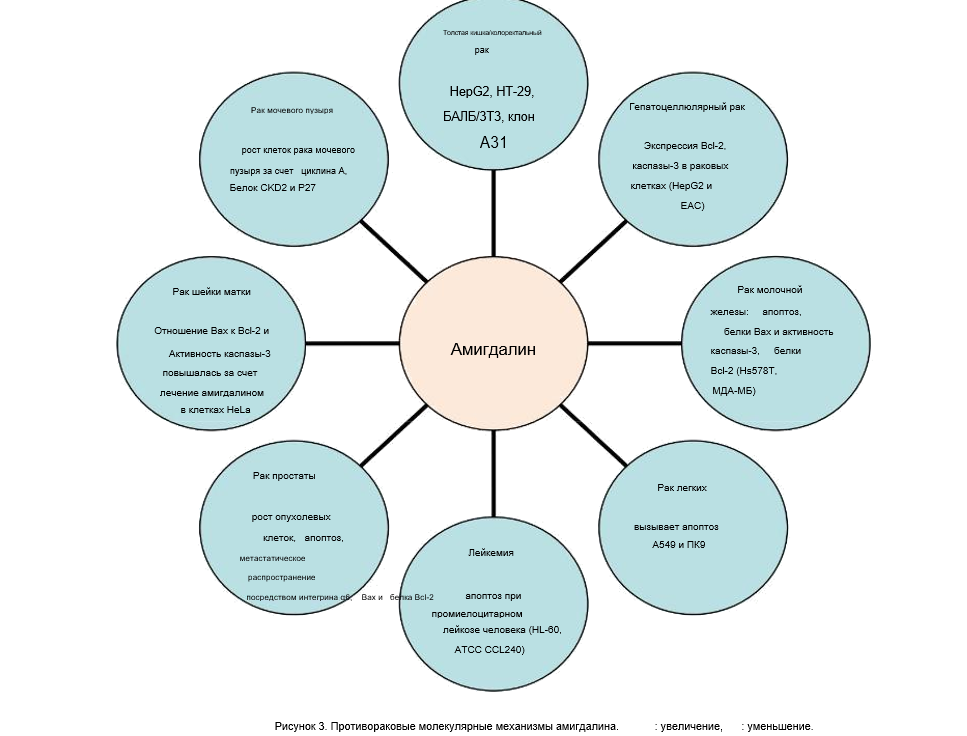
эффекты и молекулярные механизмы амигдалина изображены на рисунке 3. Клинические исследования на людях
Механизмы действия амигдалина изображены на рисунке 3. Клинические исследования на людях, а
также на раковых клетках человека и животных представлены в таблице 1.
а также в раковых клетках человека и животных представлены в табл. 1.
3.2.1. Рак легких
Амигдалин может быть полезен в качестве вспомогательного терапевтического средства при опухолях легких.
Этот ком- 3.2.1. Рак легких
фунт значительно индуцировал апоптоз клеток рака легких A549 и PC9 в определенной дозе. Амигдалин может быть полезен в качестве совместного терапевтического агента при опухолях легких. Этот взаимозависимый путь посредством митохондриально-опосредованного и каспазозависимого апоптоза
значительно индуцировал апоптоз клеток рака легких A549 и PC9 в дозовом пути [41]. Одновременно в клетках рака легких A549 и PC9 наблюдалось увеличение цитохрома C и усиление каспазозависимой активности посредством
митохондриально-опосредованной и каспазозависимой активности апоптоза 9 и каспазы-3. В пробирке
путь [41]. Одновременно увеличение цитохрома С и усиление каспаз- ингибирования пролиферации клеточных линий рака легкого H1299/M и PA/M требовали высокой
Активность 9 и каспазы-3 наблюдалась в клетках рака легких A549 и PC9. In vitro ингибируют концентрацию амигдалина [42]. Однако при более низкой концентрации амигдалина это было
Для пролиферации клеточных линий рака легких H1299/M и PA/M требовалась высокая концентрация. Было обнаружено, что инвазионная и миграционная способность раковых клеток H1299/M PA/M была
амигдалина [42]. Однако при более низкой концентрации амигдалина наблюдалось его значительное ингибирование [42]. Таким образом, было высказано предположение, что амигдалин, вероятно, обладает способностью к инвазии и
миграции раковых клеток H1299/M PA/M, обладая значительной временной метастатической активностью, индуцируя апоптоз и ингибируя пролиферацию рака легких.
отношенииингибируетсяклеток[42]. [42]Таким. образом, было высказано предположение, что амигдалин, вероятно, обладает антиметастатической активностью в
индуцируя апоптоз и ингибируя пролиферацию клеток рака легких [42].
3.2.2. Рак молочной железы
3.2.2. Рак молочной железы
Было показано, что амигдалин индуцирует апоптоз и ингибирует адгезию молочной железы.
Примечательнозначительн,что усиливалобоих апоптоз путем подавления пролиферации клеток и повышения эффективности лучевой терапии за счет индукции остановки клеточного цикла (на стадиях клеточного цикла G1 и суб-G1) [11]. Также было обнаружено, что амигдалин снижает миграцию клеток MDA-MB-231 в большей степени, чем клеток MCF-7 [43]. Кроме того, было высказано предположение, что ингибирование протеолитических ферментов способствует активации апоптотических событий в клетках рака молочной железы MCF-7 [44]. Кроме того, было показано, что амигдалин увеличивает экспрессию Bax и снижает экспрессию Bcl-2 в клетках рака молочной железы SK-BR-3 и MCF-7. Однако по сравнению с конъюгатом аффитела амигдалин-ZHER2 влияние на экспрессию Bax и Bcl-2 в клетках SK-BR-3 было сильнее, чем в клетках MCF-7 [45]. Также была продемонстрирована способность амигдалина уменьшать рост клеток рака молочной железы человека MCF-7 и T47D в зависимости от концентрации путем стимуляции производства малонового диальдегида (MDA) и окисленного глутатиона . Более того, наблюдалось значительное снижение общего уровня глутатиона и активности глутатионредуктазы в клетках рака молочной железы [46].
3.2.3. Рак простаты
Амигдалин дозозависимо ингибировал рост опухоли и уменьшал опухолевые клоны в клеточных линиях рака простаты путем ингибирования фазы G0/G1 [47]. Более того, было очевидно ингибирование роста клеток рака предстательной железы и роста опухоли под действием амигдалина, что указывает на функцию метаболических ферментов бетаглюкозидазы (β-глюкозидазы) и роданезы в регулировании противораковой активности амигдалина in vivo [10]. Активацию амигдалина β -глюкозидазой можно рассматривать как стратегию ферментной/лекарственной терапии, которая может стать новым многообещающим подходом к таргетному лечению рака простаты [48]. Было также обнаружено, что воздействие амигдалина на некоторые клетки рака предстательной железы, такие как DU-145, ингибирует распространение метастазов, чему способствует интегрин α6 [49].
3.2.4. Колоректальный рак
- альтернативной и традиционной медицине амигдалин обычно используется для профилактики и лечения
злокачественных новообразований колоректальных опухолей [50]. Было обнаружено , что противораковый эффект амигдалина на клетки колоректального рака, например, на клетки колоректального рака SNU-C4 человека, усиливается за счет снижения экспрессии генов, связанных с клеточным циклом [51]. Сообщалось, что клетки рака толстой кишки более чувствительны к действию амигдалина по сравнению с нормальными клетками из-за более высокой концентрации β-глюкозидазы и более низких уровней печеночного фермента роданезы, который может превращать цианид в относительно безвредное соединение тиоцианат [52].
3.2.5. Рак шейки матки
Доказано, что амигдалин значительно ингибирует пролиферативную активность клеток рака шейки матки HeLa
- Антиапоптотический белок Bcl-2 подавлялся, а проапоптотический Bax повышался в клетках HeLa, обработанных амигдалином [22]. Более того, соотношение Bax-к-Bcl-2 и активность каспазы-3 увеличивались при обработке амигдалином в клетках HeLa, усиливая апоптотический эффект амигдалина на клетки рака шейки матки [22,53].
3.2.6. Рак желудочно-кишечного тракта
Было продемонстрировано, что амигдалин стимулирует процесс апоптоза путем повышения
экспрессии каспазы-3 и снижения экспрессии Bcl-2, а также ингибирования пролиферации
гепатоцеллюлярных раковых клеток HepG2 и EAC и повышения экспрессии Beclin-1 [54].
Примечательно , что комбинация амигдалина с метформином показала многообещающий эффект
по сравнению с монотерапии амигдалином; их комбинация была более цитотоксичной, демонстрируя
большую способность индуцировать апоптоз и останавливать клеточный цикл в гепатоцеллюлярных раковы
Было показано, что помимо этой комбинации активность амигдалина с цинком приводит к усилению апоптотического эффекта при лечении HepG2 по сравнению с действием амигдалина без цинка [56].
3.2.7. Другие злокачественные
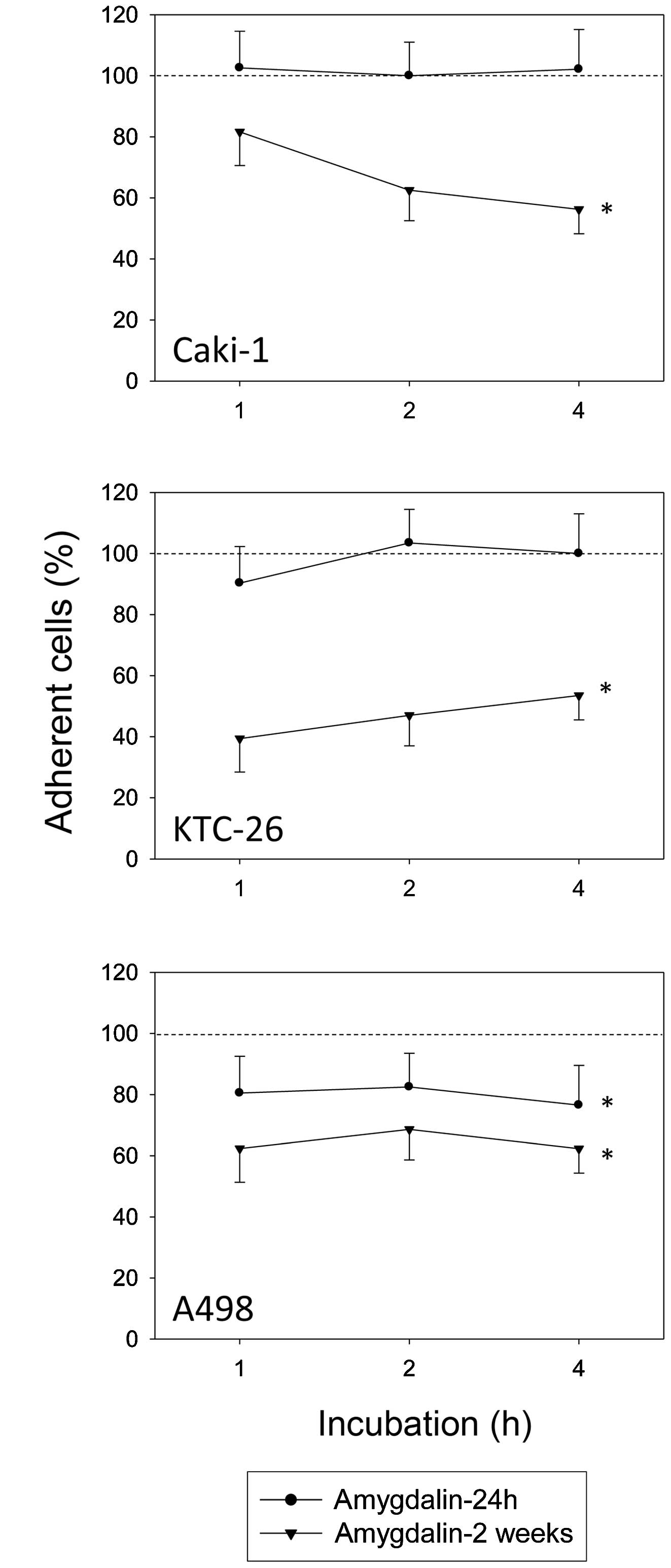
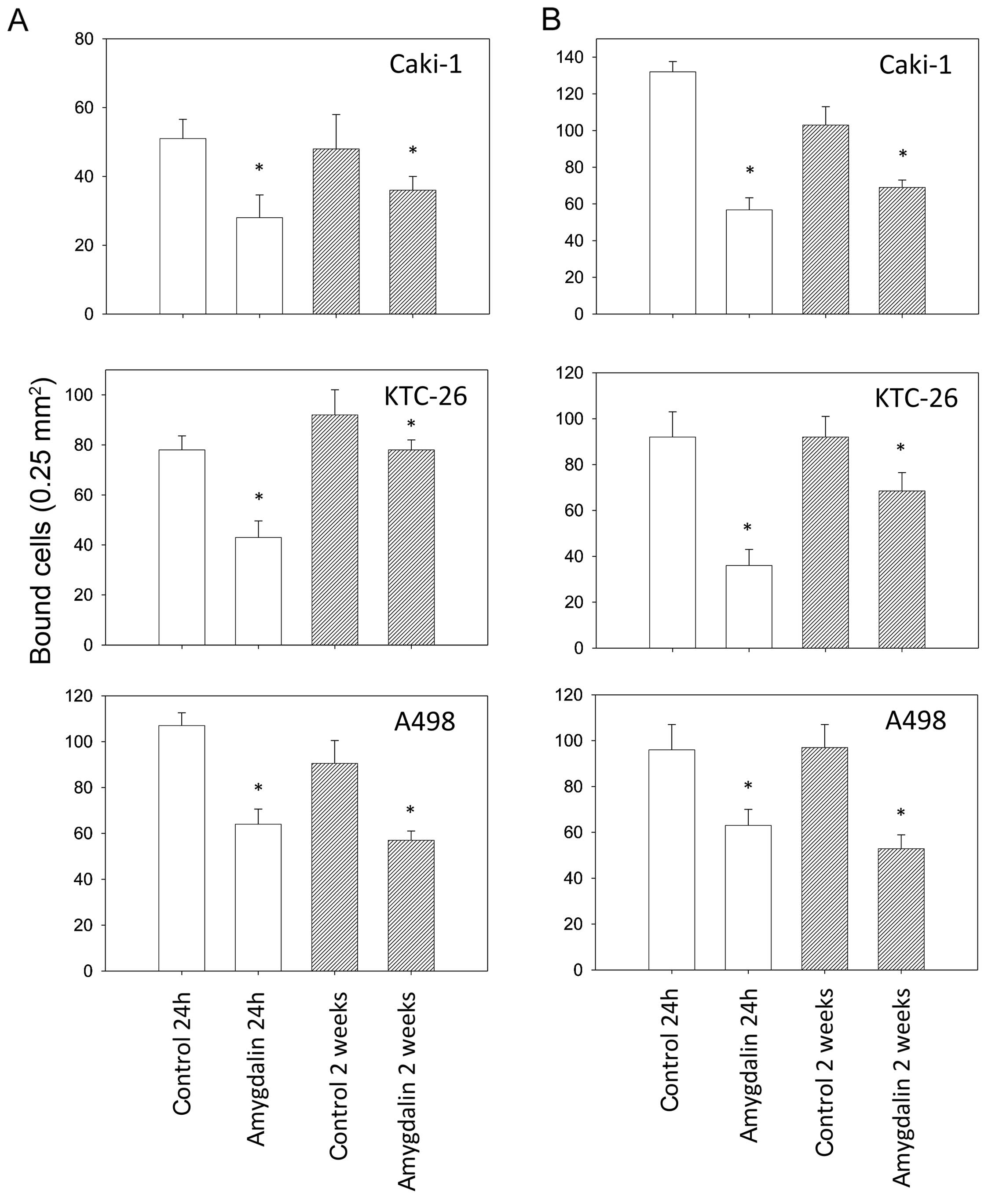
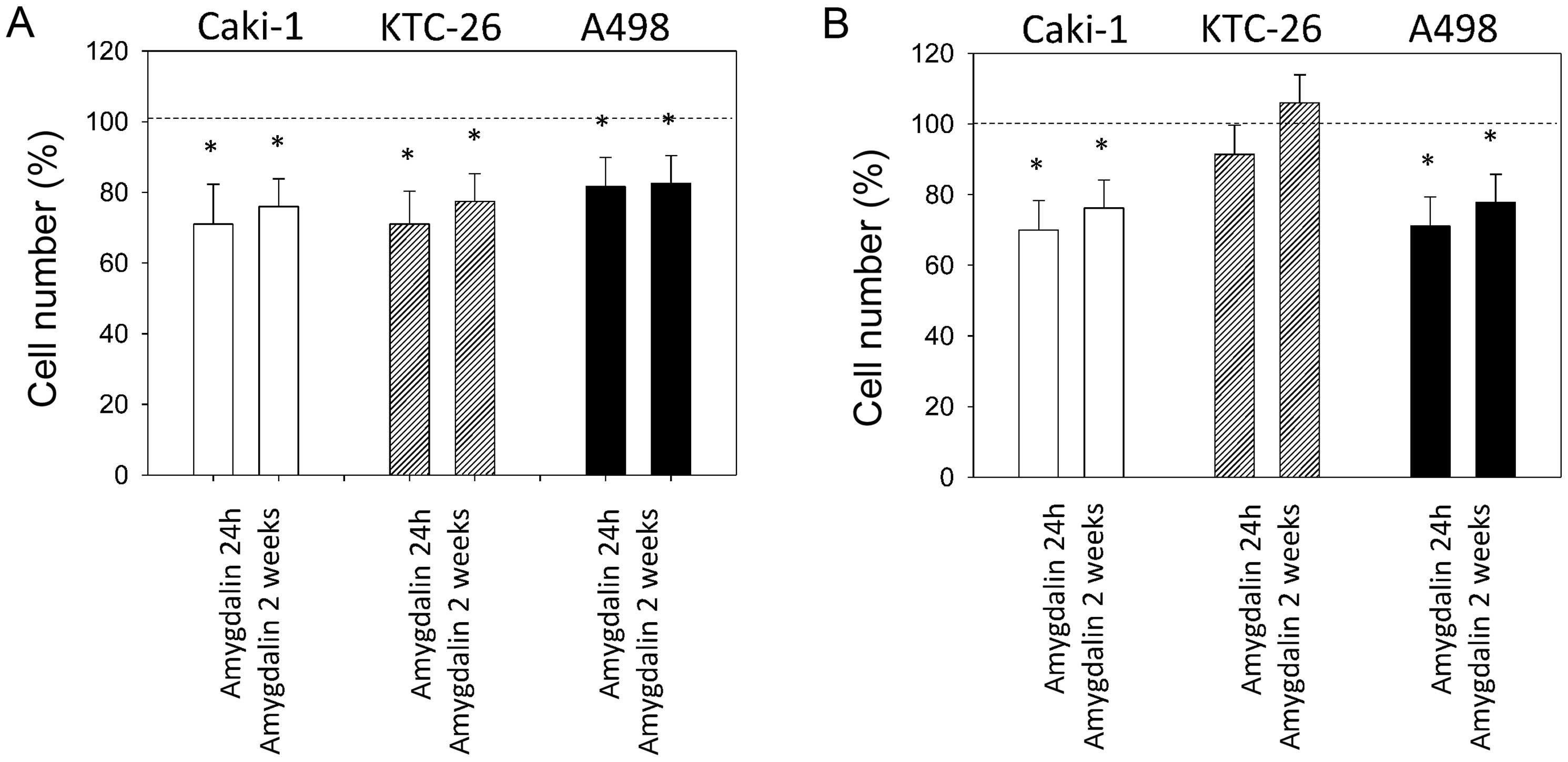
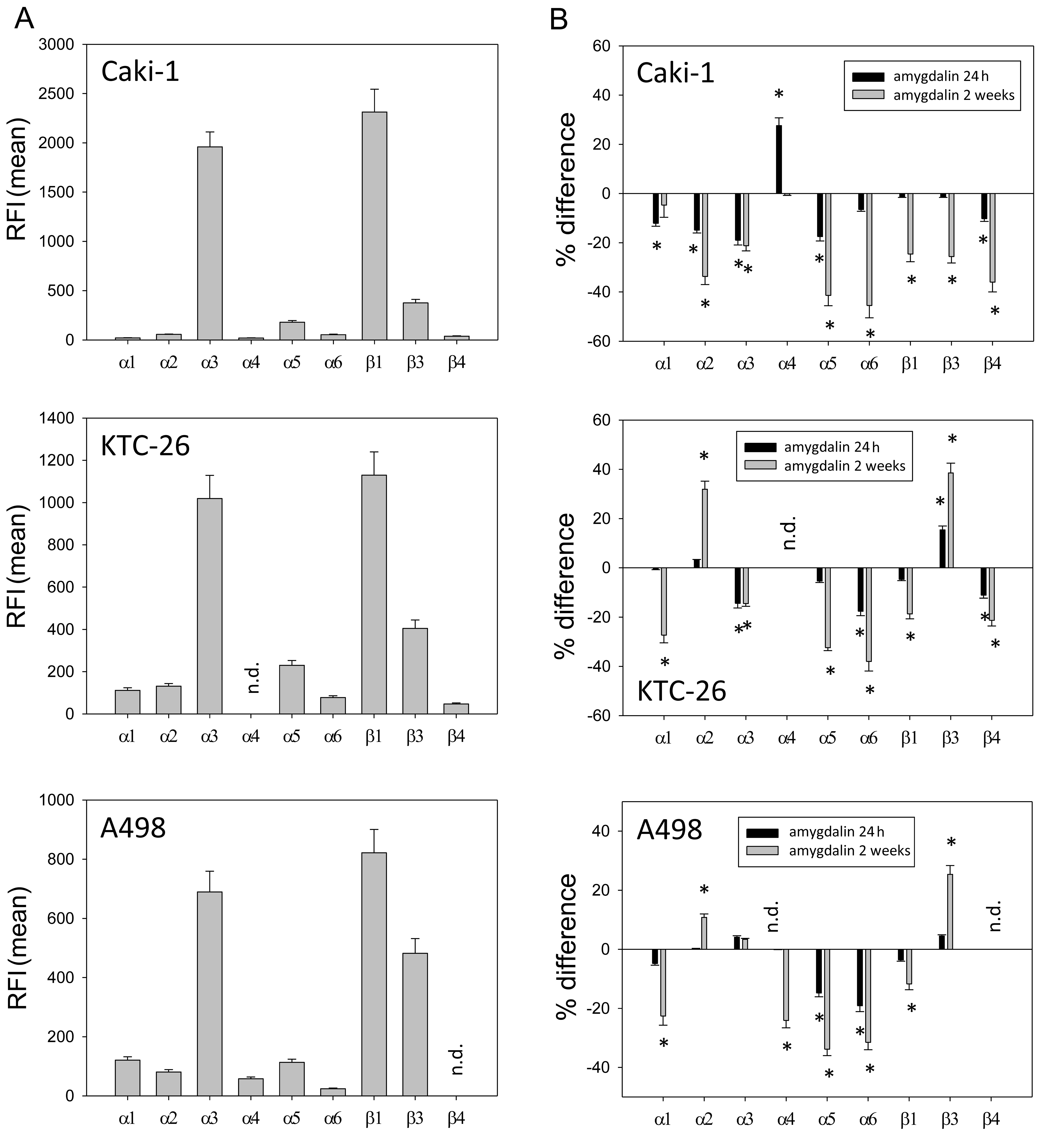
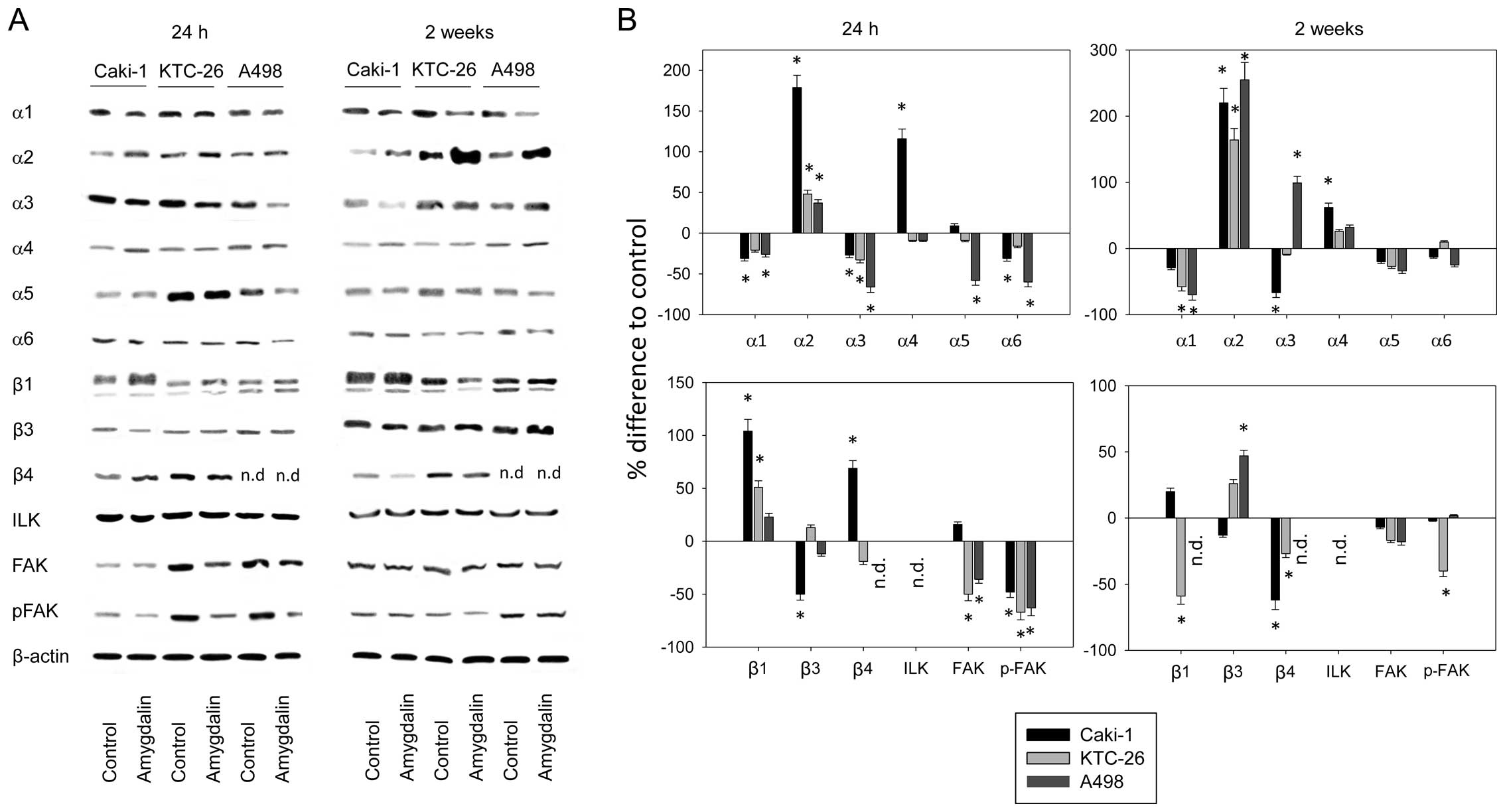
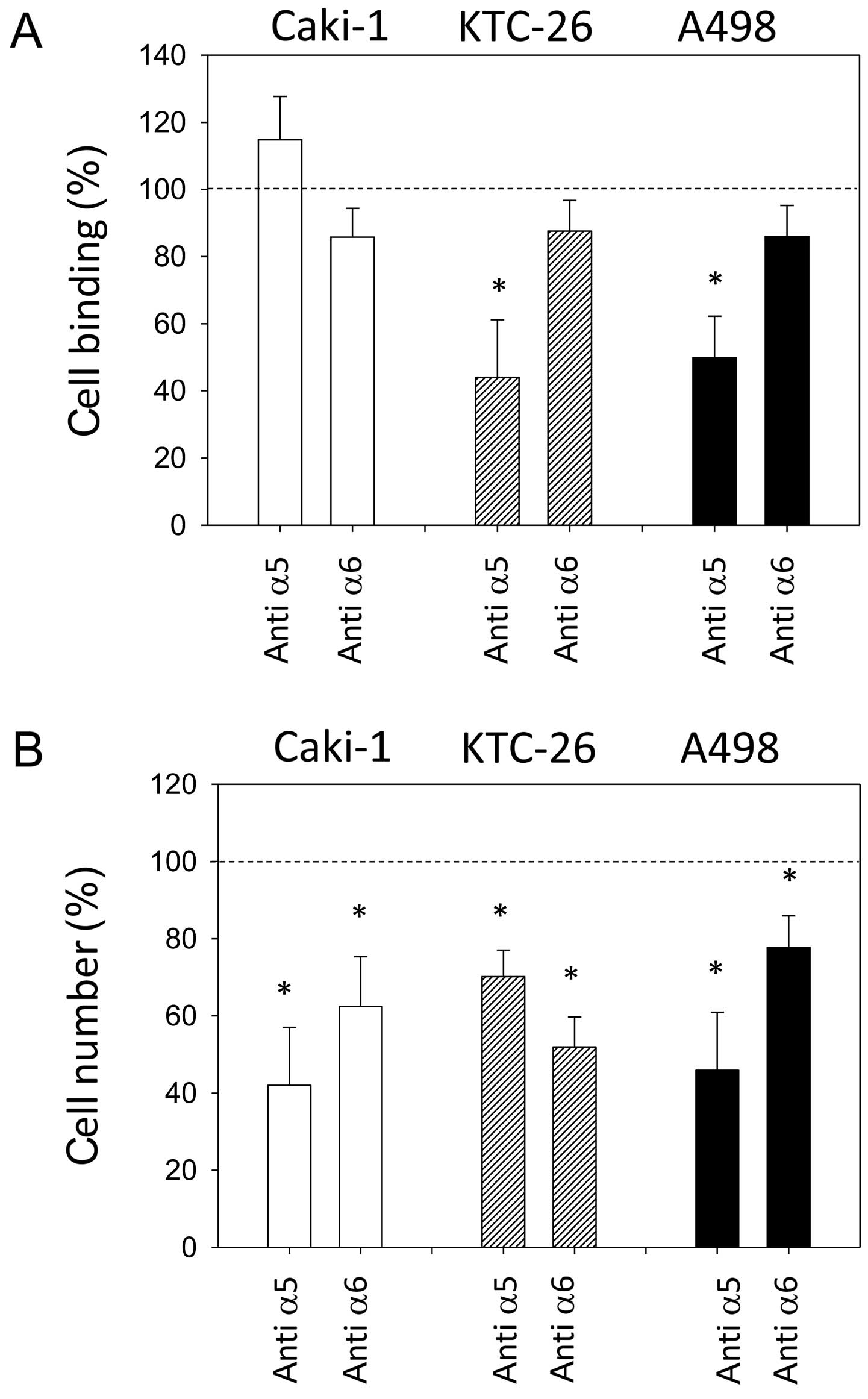
новообразования опухолей. Ингибирующее действие амигдалина на маркеры роста и дифференцировки E- и N-кадгерин в клетках почечно-клеточного рака (ПКР) было также продемонстрировано при применении 10 г/мл амигдалина к клеточным линиям ПКР A498, Caki-1. и KTC-26 в течение 24 часов или 2 недель in vitro [35]. Исследование влияния амигдалина (1,25–10 мг/
мл) на несколько клеточных линий рака мочевого пузыря (UMUC-3, RT112 и TCCSUP) также показало положите
Наиболее заметное воздействие амигдалина связано с осью cdk2-циклин А.
Исследования по нокдауну siRNA показали положительную связь с cdk2/циклином.
Также было обнаружено, что амигдалин ингибирует развитие опухоли за счет подавления CDK2 и циклина [57]. Напротив, колониеобразующие клетки из лейкозных клеточных линий и нормального костного мозга были относительно толерантны к амигдалину и его метаболитам in vitro. Хотя наблюдалось увеличение скорости апоптоза, не наблюдалось избирательного разрушения между линиями лейкозных клеток человека и нормальными клетками костного мозга [58].
Таблица 1. Исследования, оценивающие противораковые эффекты и противораковые молекулярные механизмы амигдалина.
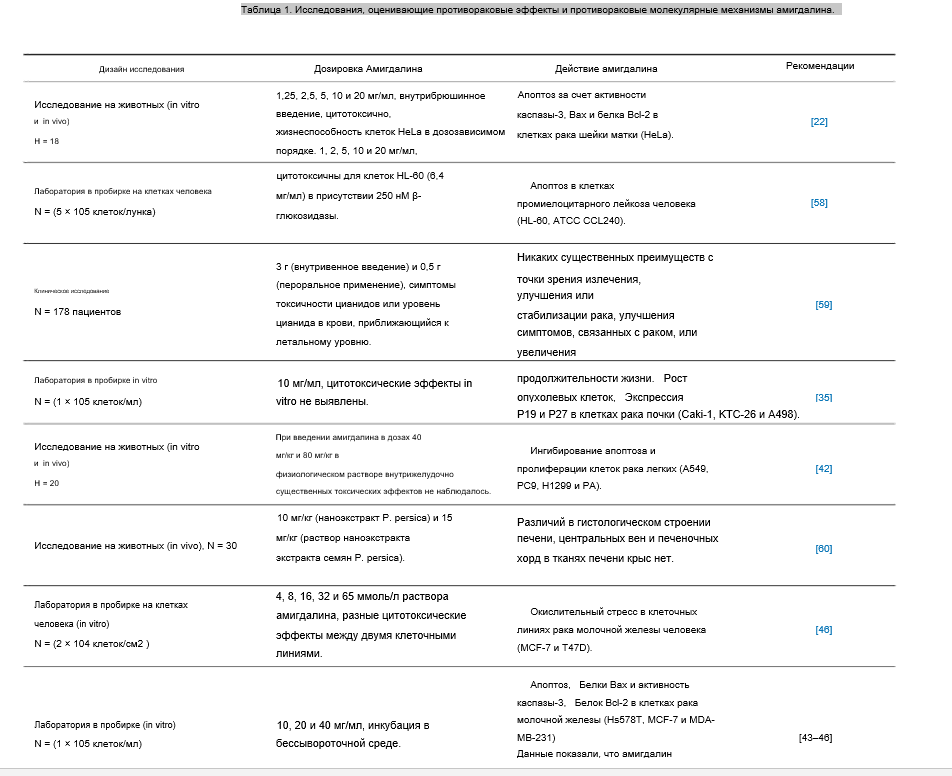
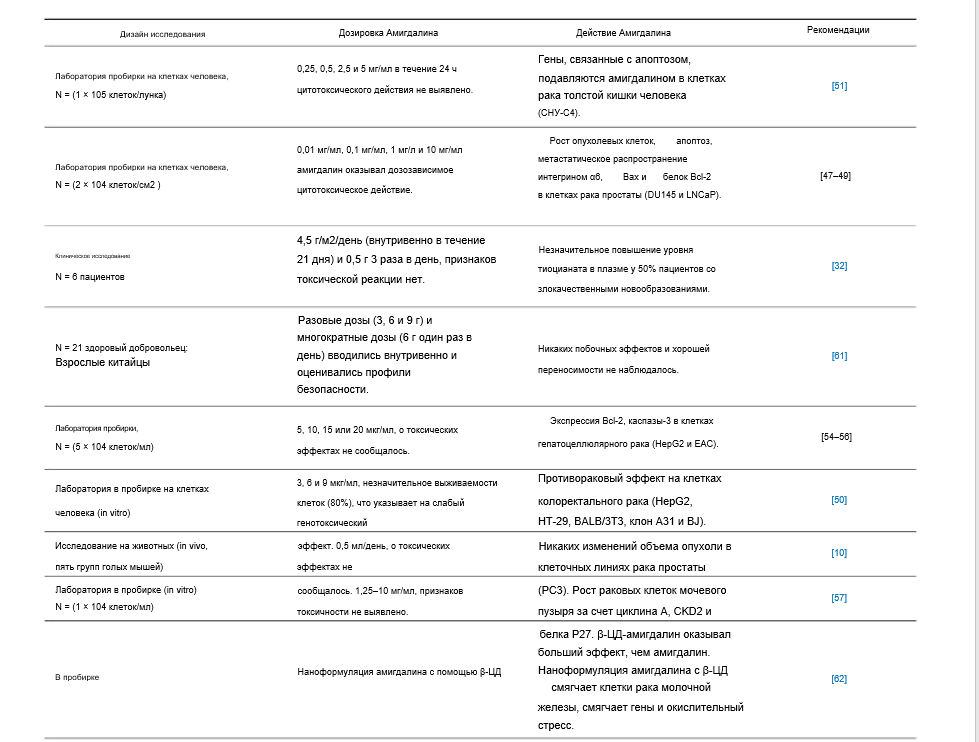

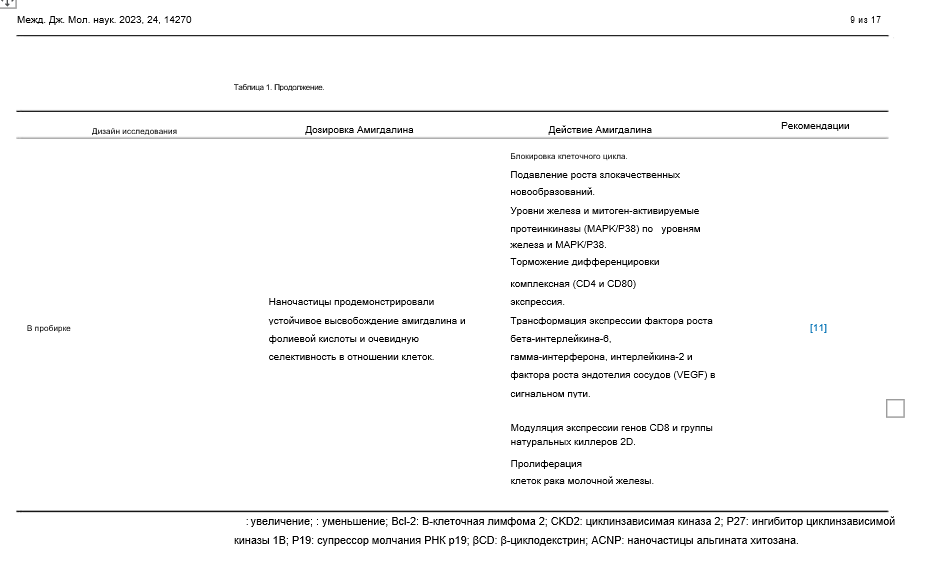
3.3. Токсичность амигдалина.
Чрезмерное употребление амигдалина может привести к отравлению (более 1 мг/л цианида в крови). Амигдалин превращается в глюкозу, бензальдегид и цианистый водород под действием эндогенного фермента (β-глюкозидазы) при измельчении фруктовых косточек. С более аналитической точки зрения, при высвобождении HCN цитохромоксидаза C может реагировать с ионом железа.
Это может индуцировать образование комплексов ионов металлов, которые лизуют клетки и ингибируют синтез АТФ [65].
Сообщалось, что амигдалин оказывает токсическое действие при приеме внутрь с добавками.
Пероральный прием 500 мг амигдалина может привести к высвобождению 30 мг цианида [66].
Токсичность цианидов может быть опасной для жизни из-за снижения утилизации кислорода
митохондриями, что приводит к гибели клеток. В раковых клетках отсутствует родханаза, фермент,
который действует как детоксифицирующий агент, связывая железо-серные центры на клеточных
мембранах и превращая HCN в менее токсичный метаболит – тиоцианат. Однако после парентерального
введения амигдалина/лаэтрила путем инъекции более 80% тиоцианата обнаруживалось в моче крыс и
кроликов [66]. Неблагоприятные побочные эффекты токсичности цианидов включают тахикардию,
спутанность сознания, тошноту, головную боль и, что более серьезно, нейромиопатию, цианоз, кому, судороги и с
За последние десятилетия было проведено несколько исследований in vitro и in vivo с использованием однократных или многократных доз и различных форм введения амигдалина (внутривенных и внутримышечных), которые не выявили образования HCN, что подчеркивает решающую роль кишечника в физиологии организма человека после потребление веществ. Анаэробные бактериальные типы, существующие в кишечнике, обладают высокой активностью β-глюкозидазы, которая необходима амигдалину для гидролиза HCN. Тем не менее, при определенных обстоятельствах было обнаружено, что токсичность HCN существует. В некоторых случаях токсичность была вызвана приемом различных доз амигдалина, и не было побочных эффектов HCN, связанных с высокими дозами. Несколько факторов, в том числе потребление пробиотиков или пребиотиков, диета и возраст, могут изменить кишечный консорциум, который отвечает за условия, при которых возникает токсичность. Примечательно, что не было зарегистрировано серьезных реакций на пероральный прием амигдалина
вдозе 3 г у больных раком, которые искали альтернативные методы лечения. Минимальная смертельная доза амигдалина для взрослого человека составляет 50 мг или 0,5–3,5 мг/кг массы тела. Однако взаимодействие с одновременным употреблением витамина С, по-видимому, активирует его неблагоприятные.
3.4. Клинические исследования амигдалина/лаэтрила при злокачественных новообразованиях опухолей человека в 20 веке
Несколько исследований продемонстрировали противораковую активность амигдалина и его
терапевтическое использование для лечения рака и облегчения боли [30,68]. Хотя научные
доказательства противоракового эффекта амигдалина, основанные на клинических испытаниях,
ограничены, было проведено несколько исследований по изучению влияния амигдалина на злокачественные оп
На протяжении многих лет рассматривалось несколько клинических испытаний комбинации амигдалин/
лаэтрил [32]. В 1980 году отдел исследований лекарственных средств Национального института рака
(NCI) объявил, что около 200 больных раком, «для которых никакое другое лечение не было эффективным», планировалось получить химическое вещество, специальную диету и дополнительные витамины (см . Институт начинает клинические испытания лаэтрила», 1980) [69]. В течение следующих двух лет были проведены два клинических исследования в области применения лаэтрила при раке человека. Первое из этих двух клинических испытаний было проведено в 1981 году на шести пациентах
- поздней стадией рака [32]. Амигдалин вводили как внутривенно, так и перорально в течение 21 дня без признаков токсических реакций. Эти данные согласуются с предыдущими наблюдениями за пациентом после самостоятельного приема лаэтрила [70]. В 1982 году было проведено еще одно клиническое исследование с участием 178 пациентов с раком, которые получали лечение амигдалином плюс «метаболическую терапию» [59]. Никаких существенных преимуществ с точки зрения излечения, улучшения или стабилизации рака, улучшения симптомов, связанных с раком, или увеличения продолжительности жизни не наблюдалось. Опасность терапии амигдалином у нескольких пациентов была подтверждена симптомами токсичности цианида или уровнями цианида в крови, приближающимися к летальному уровню [59,69,70]. Однако следует отметить, что эти клинические испытания были проведены более 40 лет назад и теперь их следует считать устаревшими, что подчеркивает необходимость проведения новых клинических испытаний, включающих введение амигдалина в различных фармацевтических формах, которые могли бы быть более переносимыми и приемлемыми для организм человека, демонстрируя большую биоактивную эффективность и нетоксичные эффекты.
3.5. Наночастицы и амигдалин в 21 веке Наночастицы считаются
многообещающим биотехнологическим методом доставки лекарств и лечения злокачественных опухолей человека, избегая при этом токсичности. Несколько исследований на линиях раковых клеток человека продемонстрировали положительные результаты в отношении метаболизма амигдалина без побочных эффектов. Как уже упоминалось, амигдалин, несмотря на его противораковое действие, столкнулся с противоречиями из-за выделения цианида. Сохаил и Аббас исследовали наночастицы альгината-хитозана (ACNP) как способ введения лекарств посредством инкапсуляции и доставки амигдалина в опухолевые клетки (H1299) [64]. Наночастицы продемонстрировали стабильное высвобождение лекарственного средства в течение десяти часов и значительную скорость набухания в слабокислой и нейтральной среде. Было показано, что ACNP оказывают большее противоопухолевое действие на клеточные линии H1299, чем свободный амигдалин, что предполагает большее поглощение клетками соединения, инкапсулированного в наночастицы. В связи с этим биомиметические и биосовместимые наночастицы бальгината-хитозана могут быть использованы в качестве выгодной системы доставки лекарств для пролонгированной и контролируемой доставки амигдалина с повышенной цитотоксической активностью в отношении опухолевых клеток, одновременно защищая нормальные ткани человека и здоровые клетки [64].
Наночастицы серебра, инкапсулирующие амигдалин и сшивающие микрокапсулы, заряженные хитозаном, также были исследованы в клеточных линиях рака молочной железы. Противораковый ответ также наблюдался в рамках контролируемого высвобождения амигдалина за счет соединения хитозана, преодолевающего низкие цитотоксические эффекты при высоких дозах [63].
Кроме того, наночастицы продемонстрировали устойчивое высвобождение амигдалина и фолиевой кислоты и очевидную селективность в отношении клеток путем подавления роста опухоли. В то же время было обнаружено, что они повышают эффективность лучевой терапии за счет усиления апоптоза, блокирования клеточного цикла и уменьшения пролиферации клеток рака молочной железы за счет
снижения уровня железа и митоген-активируемых протеинкиназ (MAPK/P38). Также была показана амигдалин-фолиев
ингибировать дифференцировку экспрессии комплекса CD4 и CD80, вызывая подавление трансформации фактора роста бета (TGF-бета)/интерлейкин-6, (IL-2)/интерферон-гамма, (INF-g)/интерлейкин-2, и Экспрессия (IL-2)/фактора роста эндотелия сосудов (VEGF) на сигнальном пути при одновременной модуляции экспрессии гена CD8 и группы естественных киллеров 2D [11].
Мосайеби и его коллеги создали наноформулу амигдалина с β-циклодекстрином, чтобы исследовать усиление его действия против миграции клеточной линии MCF-7, апоптоза и миграции генов. Наноформулированный амигдалин показал больший эффект на опухолевые клетки, чем один амигдалин [62].
3.6. Пищевые добавки с амигдалином для лечения рака Амигдалин, лаэтрил
или витамин B17 с 1845 года заявлялись в качестве средства для лечения различных заболеваний, особенно злокачественных опухолей [33]. Однако в 1982 году возникло мнение, что амигдалин может быть токсичным препаратом и неэффективен при лечении рака [59].
Недавние теоретические и практические разработки показали, что амигдалин может оказывать благотворное воздействие на больных раком [28,62,63]. Амигдалин использовался для лечения рака как в виде монотерапии, так и в сочетании с метаболической терапией. Поэтому стоит отметить, что токсичность витаминных добавок не является редким явлением, и амигдалин рекомендуется пациентам в качестве пищевой добавки при раке, при этом предлагаются высокие дозы [71]. Таблетки и капсулы амигдалина в настоящее время продаются как натуральная пищевая добавка под неправильным названием лаэтрил или сомнительным названием «витамин B17» [72].
Некоторые исследования клинических случаев продемонстрировали рецидив метаболического ацидоза после массивной передозировки амигдалина и опасной для жизни токсичности цианидов, включая нефрогенный несахарный диабет [73–76]. Токсичность амигдалина может быть вызвана ядовитым составным продуктом бензальдегида и цианида после перорального приема [35]. Как токсикологи, так и нефрологи должны знать о способности этого «витамина» вызывать отравление цианидами [ 77]. Кроме того, в настоящее время существует серьезная обеспокоенность тем, что натуральные пищевые добавки не подвергаются строгим аналитическим и клиническим испытаниям. В соответствии с Регламентом Европейского Союза ((EC)
- 178/2002), касающимся общего законодательства в области пищевых продуктов, пищевые добавки считаются пищевыми продуктами, а не лекарственными средствами [78]. Согласно приведенным выше данным, предполагающим, что клиническое использование пищевых добавок амигдалина может сопровождаться неблагоприятными побочными эффектами, соотношение риска и пользы не является благоприятным д Более того, амигдалин ошибочно называют витамином B17; соединение не является витамином [36].
- Дискуссия
альтернативной медицине амигдалин уже несколько десятилетий считается противораковым средством без строгого научного подтверждения его эффективности и безопасности. Несколько тематических исследований выявили риск плохо регулируемых добавок [79]. Недавние исследования in vitro продемонстрировали, что амигдалин может оказывать противораковую активность, влияя на клеточный цикл, способствуя апоптозу и цитотоксичности, а также модулируя иммунный ответ [29,80,81].
Однако клинические исследования показали, что метаболиты амигдалина могут превращаться в синильную
кислоту и что накопление синильной кислоты с течением времени может привести к неблагоприятному токсическому эффекту у человека [82].
Более того, доступные в настоящее время исследования имеют некоторые ограничения. На сегодняшний день проведено лишь несколько исследований на животных in vivo . Кроме того, результаты исследований противоречивы, возможно, из-за неоднородности конструкции их методов. Доза, форма вещества, тип введения, отсутствие РКИ на людях, а также отсутствие клинических испытаний фазы III и IV являются существенными ограничениями для рекомендаций по назначению амигдалина для профилактики и/или лечения рака в клинической практике. Таким образом, преимуществом нашей обзорной статьи является выявление пробела в литературе относительно проведения клинических исследований амигдалина. С другой стороны, до сих пор недостаточно надежных данных о биодоступности амигдалина и соответствующих уровнях его концентрац
циркуляция. Соответственно, не существует данных о том, можно ли использовать амигдалин в качестве совместного лечения с другими химиотерапевтическими средствами.
Значительный научно-исследовательский разрыв между концом 20-го века и началом 21-го века возник из-за того, что до сих пор исследовательская деятельность проводилась ограниченно . Более того, большинство исследований, подтверждающих противораковое действие амигдалина, было проведено на различных линиях раковых клеток in vitro. Таким образом, разумно предположить, что его противораковые эффекты не могут быть экстраполированы на человека. Противоречивые результаты исследований in vitro и in vivo [41,51,60,83–86] и нескольких клинических исследований [61] еще раз подчеркивают необходимость дополнительных исследований
- области терапии рака, особенно связанных с изучением новую, нетоксичную формулу амигдалина, принимая во внимание роль нанотехнологий в современную эпоху биомедицинской науки. В целом, существует большая потребность в дальнейших исследованиях на животных in vivo , а также клинических исследованиях на людях для изучения потенциальной эффективности профилактики и/или лечения амигдалина против развития и прогрессирования раковых заболеваний. Кроме того, расхождения, обнаруженные в некоторых клинических исследованиях, могут быть связаны с небольшими размерами выборки, а также с различными персонализированными характеристиками участников , что подчеркивает необходимость проведения хорошо спланированных клинических исследований с адекватными размерами выборки в будущем.
- 2015 году Кокрановская база данных систематических обзоров заявила, что лаэтрил или амигдалин оказывают благоприятное воздействие на больных раком, что в настоящее время не подтверждается научно обоснованными клиническими данными [28]. В приведенном выше отчете документально подтверждено, что существует значительный риск серьезных побочных эффектов от отравления цианидом после введения лаэтрила или амигдалина, особенно после перорального приема
- Таким образом, баланс риска и пользы лаэтрила или амигдалина для лечения рака остается однозначно сомнительным [28]. Однако с 2015 года было проведено много исследований. Более того, Национальный институт рака сообщил, что частота отравлений цианидами намного выше при пероральном приеме лаэтрила, поскольку кишечные бактерии и некоторые часто употребляемые в пищу растения содержат ферменты (бета-глюкозидазы), которые активируют высвобождение цианида после при
Наконец, эффективно применяя последние разработки в процессах разработки лекарств, амигдалин можно использовать в качестве ведущего соединения для синтеза и разработки более биологически активных аналогов, родственных амигдалину, с более высокой эффективностью и целевой селективностью, а также со сниженными нежелательными побочными эффектами и улучшенной биодоступностью при пероральном приеме. Например, в последние годы методы машинного обучения произвели революцию в области разработки лекарств на основе структуры [88].
Подходы искусственного интеллекта для ускорения и предотвращения сбоев в разработке лекарств также могут быть применены в случае амигдалина [89]. Помимо методов машинного обучения и искусственного интеллекта, квантовые вычисления являются еще одним значительным достижением
- области технологий генеративной химии и процессов открытия лекарств, которые исследователи
могут использовать в случае амигдалина [90]. Функционализация на поздней стадии также создает новые проблемы для введения новых групп химических фрагментов, таких как амигдалин и его будущие потенциальные синтетические аналоги, ближе к концу синтетической последовательности, что означает, что новые молекулы, к которым можно быстро получить доступ без трудоемких химических процессов de novo. синтез [91]. Этот конкретный подход может предложить такие преимущества, как эффективный доступ к разнообразным библиотекам для изучения взаимосвязей структура-активность и улучшение физико-химических и фармакокинетических свойств [91].
Компьютерное открытие лекарств также может обеспечить быструю идентификацию весьма разнообразных, мощных, селективных по мишеням и подобных лекарству лигандов белков, открывая новые возможности для экономически эффективной разработки более безопасных и эффективных низкомолекулярных методов лечения, таких как амигдалин . 92]. Липофильность и биомиметические свойства также играют важную разную и перекрывающуюся роль в поддержке процесса открытия лекарств, главным образом за счет увеличения пероральной биодоступности потенциальных лекарств и значительного снижения их потенциальных неблагоприятных побочных эффектов [93,94]. Липофильность имеет уникальную ценность на ранних этапах разработки лекарств для скрининга библиотек и для первоначальной идентификации перспективных соединений, в то время как биомиметические свойства полезны для экспериментальной оценки свойств абсорбции, распределения, метаболизма и выведения (ADME) синтезированных новых соединений. поддержка определения приоритетности потенциальных лекарств и руководство дальнейшим синтезом; эти подходы могли бы
могут быть применены в случае амигдалина для получения новых синтетических аналогов амигдалина с повышенной пероральной биодоступностью и уменьшенными нежелательными побочными эффектами [93,94].
- поддержку вышеизложенных соображений недавно были применены модели двойного докинга и молекулярной динамики для разработки новых подходов к объяснению влияния амигдалина на динамическое поведение комплекса Bcl-2/BAX, каспазы-3 и PARP- 1 . 95]. Эти молекулярные мишени могут играть определяющую роль в путях апоптоза и могут рассматриваться как потенциальные терапевтические мишени для лечения рака [95]. В целом, эти компьютерные наблюдения можно считать хорошим доказательством отказа от убеждения, что цианогруппа амигдалина, которая является основной группой, ответственной за противораковую активность амигдалина [95], может быть заменена другой химической группой с меньшими побочными эффектами. [96,97]. Кроме того, результаты вычислений подтвердили, что амигдалин имеет уникальную структуру и может считаться эталонным соединением для разработчиков лекарств
при разработке новых молекул со схожими эффективными противораковыми химическими структурами, но с меньшими неблагоприятными побочными эффектами [95–97].
- Выводы
- настоящее время имеется несколько линий данных in vitro , свидетельствующих о том, что
амигдалин и его синтетический аналог лаэтрил обладают противораковыми свойствами, а предыдущие и предстоящие исследования на животных in vivo , по-видимому, подтверждают их противораковые свойства. Однако существуют определенные возникающие и серьезные проблемы, связанные с их токсичностью из-за их цианогруппы, а также из-за плохой биодоступности при пероральном приеме. В связи с этим необходимо эффективно применять новые технологии при разработке лекарств, чтобы свести к минимуму их неблагоприятные побочные эффекты, а также повысить их пероральную биодоступность. В связи с этим химики-медики должны сосредоточиться на лабораторном синтезе химических аналогов, которые могли бы поддерживать противораковую активность амигдалина, одновременно снижая его неблагоприятные побочные эффекты. Технология наночастиц кажется многообещающей для увеличения биодоступности и противораковой активности амигдалина при одновременном снижении его токсических эффектов. Однако в литературе существует значительный пробел, касающийся проведения клинических испытаний по изучению его противораковой активности на людях и обеспечению безопасности амигдалина до его внедрения в клиническую практику. Сочетание технологии наночастиц с использованием новых и более безопасных синтетических аналогов амигдалина.