Амигдалин подавляет рост клеток почечно-клеточной карциномы in vitro
Амигдалин подавляет рост клеток почечно-клеточной карциномы in vitro
- Авторы:
- Ева Юнгель
- Анита Томас
Аннотация
Хотя амигдалин используется многими онкологическими больными в качестве противоопухолевого средства, отсутствует информация об эффективности и токсичности этого природного соединения. В настоящем исследовании изучалось ингибирующее действие амигдалина на рост клеток почечно-клеточной карциномы (ПКР). Амигдалн (10 мг/мл) применялся к линиям клеток ПКР, Caki-1, KTC-26 и A498, в течение 24 часов или 2 недель. Необработанные клетки служили в качестве контроля. Рост и пролиферацию опухолевых клеток определяли с помощью тестов MTT и BrdU, а также оценивали фазы клеточного цикла. Экспрессия активирующих клеточный цикл белков cdk1, cdk2, cdk4, циклина A, циклина B, циклина D1 и D3, а также ингибирующих клеточный цикл белков p19 и p27 изучалась с помощью вестерн-блоттинга. Также исследовалась поверхностная экспрессия маркеров дифференциации E- и N-кадгерина. Функциональная блокада siRNA использовалась для определения влияния нескольких белков на рост опухолевых клеток. Лечение амигдалином вызвало значительное снижение роста и пролиферации клеток RCC. Этот эффект коррелировал с уменьшением процента клеток RCC в фазе G2/M и увеличением процента клеток в фазе G0/1 (Caki-1 и A498) или остановкой клеточного цикла в S-фазе (KTC-26). Кроме того, амигдалин вызвал заметное снижение белков, активирующих клеточный цикл, в частности cdk1 и циклина B. Функциональное блокирование cdk1 и циклина B привело к значительному снижению роста опухолевых клеток во всех трех линиях клеток RCC. Помимо ингибирующего воздействия на рост, амигдалин также модулировал маркеры дифференциации, E- и N-кадгерин. Следовательно, воздействие амигдалина на клетки RCC подавляло прогрессирование клеточного цикла и рост опухолевых клеток за счет нарушения экспрессии cdk1 и циклина B. Более того, мы отметили, что амигдалин влияет на маркеры дифференциации. Таким образом, мы предполагаем, что амигдалин оказывает противоопухолевое действие на ПКР in vitro.
Введение
Почечно-клеточная карцинома (ПКР) является наиболее распространенным раком почки и самой агрессивной урологической опухолью, и ее заболеваемость растет ( 1 ). Примерно у 15-20% пациентов с ПКР уже есть метастазы на момент постановки диагноза, в то время как у 30% пациентов метастазы развиваются во время терапии. После метастазирования прогноз для пациентов неблагоприятный. Расширение знаний о молекулярных механизмах действия ПКР способствовало разработке таргетной терапии в течение последнего десятилетия, тем самым улучшая прогноз для пациентов на поздних стадиях заболевания. Однако, несмотря на терапевтические достижения, прогноз для пациентов с ПКР остается неблагоприятным, 5-летняя выживаемость остается между 5 и 12% ( 2 , 3 ).
Большинство пациентов с прогрессирующим раком почки хотят активно участвовать в борьбе с раком и/или избегать неблагоприятных побочных эффектов, которые часто возникают при традиционной терапии. Поэтому многие пациенты обращаются к комплементарной и альтернативной медицине (КАМ). Более 50% онкологических больных в Европе ( 4 ) и до 80% онкологических больных в Соединенных Штатах ( 5 ) используют КАМ вместе с традиционной терапией или вместо нее.
Амигдалин (D-манделонитрил-β-гентиобиозид) — это природное соединение, которое часто используют онкологические больные. Он содержится в косточках абрикосов, персиков, яблок и горького миндаля ( 6–8 ). Первые исследования по использованию амигдалина онкологическими больными были проведены в России в 1840-х годах ( 9 ). В 1920-х годах амигдалин также назначали онкологическим больным в Соединенных Штатах ( 10 ). В 1950-х годах был представлен полусинтетический , химически иной производный амигдалина, лаэтрил. После появления лаэтрила термины амигдалин и лаэтрил часто использовались как синонимы, что затрудняло выводы из исследований, в которых не делалось различий между этими двумя соединениями ( 11 ) . В 1970-х годах амигдалин/леатрил стал одним из самых популярных нетрадиционных методов лечения рака. К 1978 году около 70 000 онкологических больных в США использовали амигдалин ( 12 ) . Национальный институт рака (NCI) инициировал несколько исследований ( 13–16 ) с отрезвляющими результатами. В резюме единственного испытания фазы II не было приписано существенной пользы амигдалину, в то время как было описано несколько пациентов с симптомами отравления цианидом (HCN) ( 13 ) . Однако качество этого исследования сомнительно, поскольку использовалась гетерогенная когорта пациентов, не были включены контрольные группы, а для внутривенной терапии использовался рацемат вместо чистого амигдалина. Все официальные суждения относительно амигдалина были основаны на этом испытании, поскольку никаких других клинических испытаний с амигдалином не доступно. Немецкий федеральный институт лекарственных средств и медицинских приборов (BfArM) ( http://www.bfarm.de/DE/Home/home_node.html ) также классифицировал амигдалин как сомнительный препарат, как и коллеги в других странах. Несмотря на противоречия и отсутствие научно обоснованных данных о пользе и рисках амигдалина, многие онкологические пациенты используют амигдалин ( 11 , 17 ). Таким образом, чтобы прояснить многие вопросы, на которые еще предстоит ответить относительно влияния амигдалина на рост и пролиферацию опухоли, в настоящем исследовании были определены прогрессия клеточного цикла и основные молекулярные режимы действия в клетках почечно-клеточного рака.
Материалы и методы
Клеточные культуры и лечение амигдалином
Линии клеток карциномы почки Caki-1, KTC-26 и A498 были приобретены у LGC Promochem (Wesel, Германия). Клетки выращивали и субкультивировали в среде RPMI-1640 (полученной у Seromed, Берлин, Германия) с добавлением 10% FCS, 20 мМ HEPES-буфера, 100 МЕ/мл пенициллина и 100 мкг /мл стрептомицина при 37°C в увлажненной атмосфере с 5% CO2 в инкубаторе. Субкультуры из пассажей 5–24 были отобраны для использования в экспериментах. Амигдалин из абрикосовых косточек (Sigma-Aldrich, Тауфкирхен, Германия) был свежерастворен в среде для культивирования клеток и затем добавлен к опухолевым клеткам в концентрации 10 мг/мл [ранее оцененной как оптимальная концентрация ( 18 )] на 24 часа или 2 недели (три раза в неделю) для оценки острого и хронического лечения. Контрольные группы оставались необработанными. Во всех экспериментах в настоящем исследовании обработанные культуры опухолевых клеток сравнивались с необработанными культурами опухолевых клеток. Для изучения токсического действия амигдалина жизнеспособность клеток определялась с помощью трипанового синего (Gibco/Invitrogen, Дармштадт, Германия).
Измерение роста, пролиферации и апоптоза опухолевых клеток
Рост клеток оценивали с помощью анализа восстановления красителя 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ) (Roche Diagnostics, Пенцберг, Германия). Клетки Caki-1 (50 мкл , 1×10 5 клеток/мл) высевали на 96-луночные планшеты для культивирования тканей. Через 24, 48 и 72 часа добавляли 10 мкл МТТ (0,5 мг/мл) еще на 4 часа. После этого клетки лизировали в буфере, содержащем 10% SDS в 0,01 М HCl. Планшеты инкубировали в течение ночи при 37°C, 5% CO 2 . Поглощение при 550 нм определяли для каждой лунки с помощью микропланшетного иммуноферментного анализа (ELISA). После вычитания фонового поглощения результаты выражались как среднее количество клеток.
Пролиферацию клеток измеряли с помощью набора для определения пролиферации клеток BrdU ELISA (Calbiochem/Merck Biosciences, Дармштадт, Германия). Опухолевые клетки, посеянные на 96-луночных планшетах, инкубировали с 20 мкл раствора для маркировки BrdU на лунку в течение 8 ч, фиксировали и детектировали с помощью анти-BrdU mAb в соответствии с инструкциями производителя. Поглощение измеряли при 450 нм с помощью ридера для микропланшетов ELISA.
Для оценки того, был ли рост опухолевых клеток нарушен или уменьшен из-за апоптоза, экспрессия аннексина V/пропидиум йодида (PI) была оценена с помощью набора Annexin V-FITC Apoptosis Detection kit (BD Pharmingen, Гейдельберг, Германия). Опухолевые клетки были дважды промыты PBS и затем инкубированы с 5 мкл Annexin V-FITC и 5 мкл PI в темноте в течение 15 минут при комнатной температуре. Клетки были проанализированы методом проточной цитометрии с использованием FACSCalibur (BD Biosciences, Гейдельберг, Германия). Процент апоптотических клеток (ранних и поздних) в каждом квадранте был рассчитан с помощью программного обеспечения CellQuest (BD Biosciences).
Процент клеток в разных фазах клеточного цикла
Анализ клеточного цикла проводился на субконфлюэнтных клеточных культурах. Популяции опухолевых клеток окрашивались PI с использованием набора реагентов CycleTEST PLUS DNA, а затем подвергались проточной цитометрии с использованием FACScan (оба от Becton-Dickinson, Гейдельберг, Германия). Из каждого образца было собрано 10 000 событий. Сбор данных проводился с использованием программного обеспечения CellQuest, а распределение клеточного цикла рассчитывалось с использованием программного обеспечения ModFit (Becton-Dickinson). Количество клеток с гейтированием в фазах G1, G2/M или S выражается в процентах.
Экспрессия белков, регулирующих клеточный цикл
Белки, регулирующие клеточный цикл, исследовали с помощью вестерн-блоттинга. Лизаты опухолевых клеток наносили на 7-15% полиакриламидный гель (в зависимости от размера белка) и подвергали электрофорезу в течение 90 мин при 100 В. Затем белок переносили на нитроцеллюлозные мембраны (1 ч, 100 В). После блокирования обезжиренным сухим молоком в течение 1 часа мембраны инкубировали в течение ночи с моноклональными антителами, направленными против следующих белков клеточного цикла, которые все были от BD Biosciences: cdk1 (IgG1, клон 1, разведение 1:2500; #610038), cdk2 (IgG2a, клон 55, разведение 1:2500; #610146), cdk4 (IgG1, клон 97, разведение 1:250; #610148), циклин A (IgG1, клон 25, разведение 1:250; #611269), циклин B (IgG1, клон 18, разведение 1:1000; #610220), циклин D1 (IgG1, клон G124-326, разведение 1:250; #554181), циклин D3 (IgG2b, клон 1, разведение 1:1000; #610280), p19 (IgG1, клон 52/p19, разведение 1:5000; #610530), p27 (IgG1, клон 57, разведение 1:500; #610244). Конъюгированные с HRP козьи антимышиные IgG (разведение 1:5000; #12-349; Merck Millipore, Темекула, Калифорния, США) служили в качестве вторичных антител. Мембраны ненадолго инкубировали с реагентом для обнаружения ECL (ECL™; Amersham/GE Healthcare, Мюнхен, Германия) для визуализации белков, а затем анализировали с помощью системы Fusion FX7 (Peqlab, Эрланген, Германия). В качестве внутреннего контроля служил β-актин (разведение 1:1000; #A5441; Sigma, Тауфенкирхен, Германия).
Поверхностная экспрессия E- и N-кадгерина
Опухолевые клетки промывали в блокирующем растворе (PBS, 0,5% BSA), а затем инкубировали в течение 60 мин при 4°C с моноклональными антителами (mAB), конъюгированными с фикоэритрином (PE), направленными против следующих антител: анти-человеческий E-кадгерин-PE (мышиный IgG2b, клон 180224; #FAB18381P) и анти-человеческий N-кадгерин-PE (крысиный IgG2a, клон 401408; #IC1388P) (оба от R&D Systems, Висбаден, Германия). Затем поверхностную экспрессию E- и N-кадгерина клеток RCC измеряли с помощью проточной цитометрии с использованием FACscan [анализ гистограммы канала FL-2H (log); 1×10 4 клеток/сканирование; BD Biosciences] и выражали в виде средних единиц флуоресценции. В качестве изотипического контроля служили крысиный IgG2a-PE (клон RG7/1.30; № 558067) или мышиный IgG2b-PE (клон 27-35; № 555743) (оба от BD Biosciences).
Блокировка экспериментов
Чтобы определить, влияют ли cdk1 и циклин B на рост опухолевых клеток в клеточных линиях Caki-1, KTC-26 и A498, клетки были трансфицированы. Опухолевые клетки (3×10 5 /6-луночные) были трансфицированы малой интерферирующей РНК (siRNA), направленной против cdk1 (Hs_CDC2_10, идентификатор гена: 983, целевая последовательность: AAGGGGTTCCTAGTACTGCAA) или циклина B (Hs_CCNB1_6, идентификатор гена: 891, целевая последовательность: AATGTAGTCATGGTAAATCAA) (оба от Qiagen, Хильден, Германия), с реагентом siRNA/трансфекции (реагент трансфекции HiPerFect; Qiagen) в соотношении 1:6. Необработанные клетки и клетки, обработанные 5 нМ контрольной siRNA (AllStars Negative Control siRNA; Qiagen), служили в качестве контролей. Затем рост опухолевых клеток определяли, как указано выше.
Статистический анализ
Все эксперименты проводились 3–6 раз. Статистическая значимость определялась с помощью U-критерия Вилкоксона-Манна-Уитни. Значение p < 0,05 считалось указывающим на статистически значимую разницу.
Результаты
Рост и пролиферация опухолевых клеток блокируются амигдалином
Воздействие амигдалина (10 мг/мл) в течение 24 ч или 2 недель привело к значительной и схожей степени ингибирования роста в течение 72 ч во всех трех линиях клеток почечно-клеточного рака, Caki-1, KTC-26 и A498, по сравнению с необработанными контрольными клетками ( рис. 1 ). Пролиферация клеток Caki-1, KTC-26 и A498 также была значительно снижена после 24 ч или 2 недель воздействия амигдалина по сравнению с контрольными клетками ( рис. 2 ). Противоопухолевые эффекты в клетках почечно-клеточного рака были сопоставимы после 24 ч и 2 недель лечения амигдалином ( рис. 2 ).
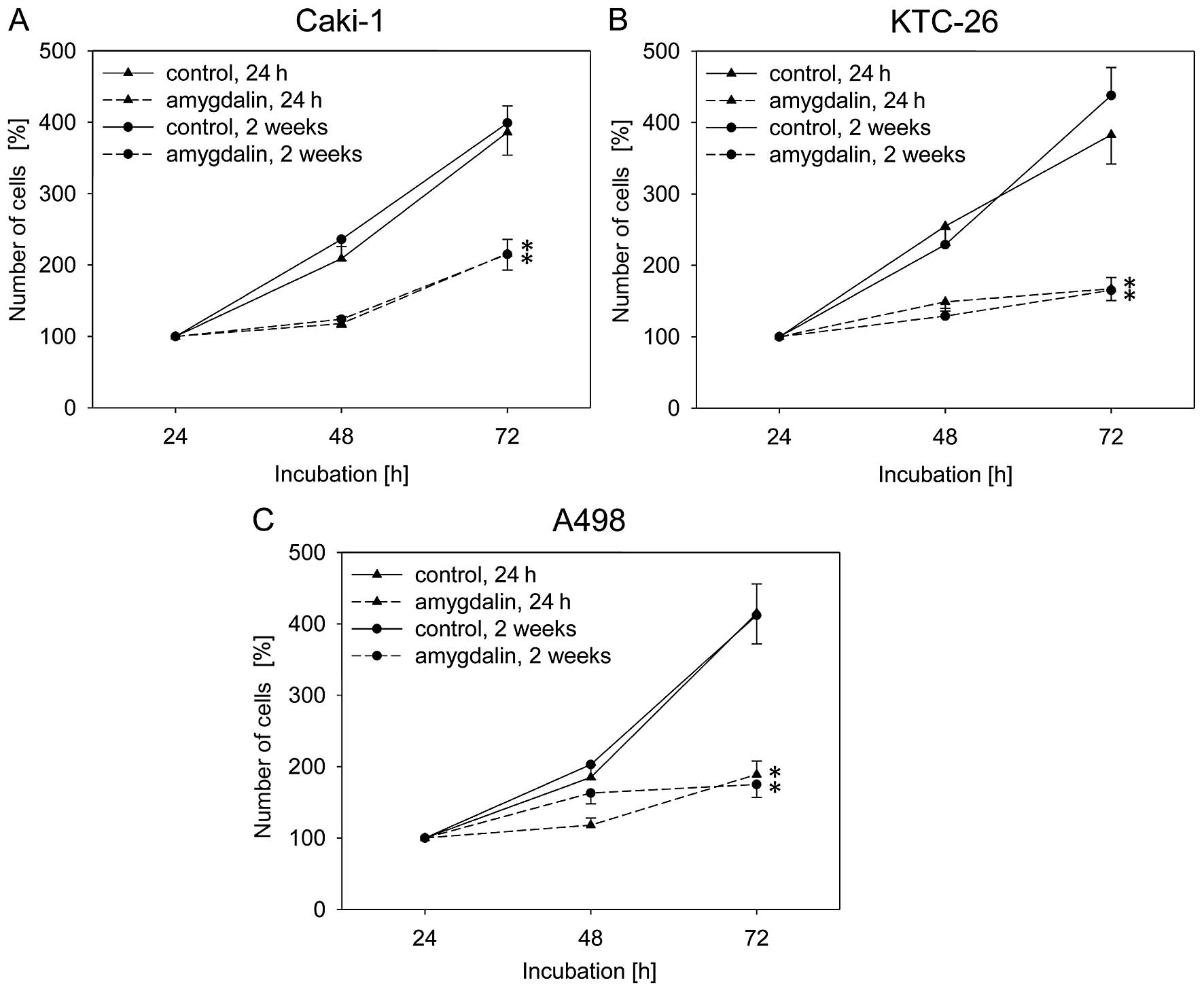 |
Рисунок 1Рост клеток почечно-клеточной карциномы (RCC), (A) Caki-1, (B) KTC-26 и (C) A498. Клетки обрабатывали 10 мг/мл амигдалина в течение 24 ч или 2 недель. Контрольные клетки оставались необработанными. Количество клеток было установлено на уровне 100% после 24 ч инкубации. Полоски указывают на среднее значение ± стандартное отклонение (SD). *p≤0,05 указывает на значительное отличие от контроля. n=5 экспериментов. |
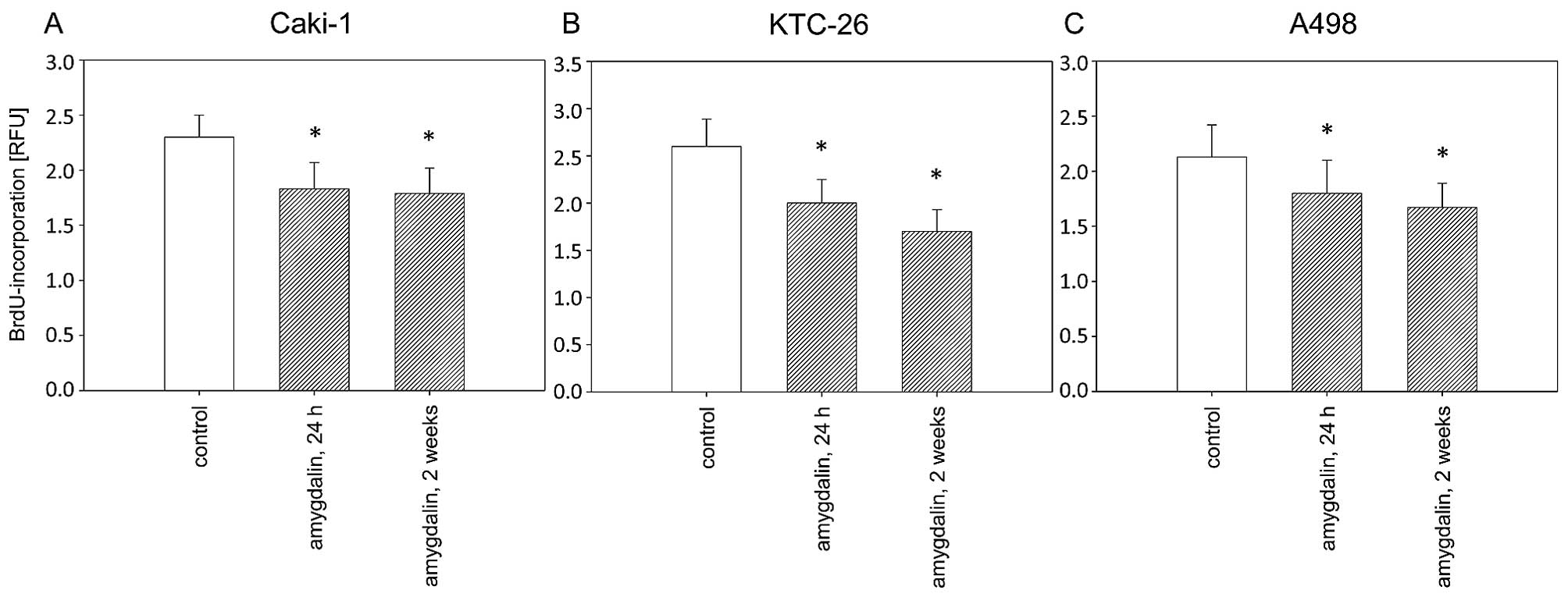 |
Рисунок 2Пролиферация клеток почечно-клеточной карциномы (RCC). Клетки (A) Caki-1, (B) KTC-26 и (C) A498 обрабатывали 10 мг/мл амигдалина в течение 24 ч или 2 недель. Контрольные группы оставались без обработки. Полоски указывают средние значения ± стандартное отклонение (SD). *p≤0,05 указывает на значимое отличие от контроля. n=5 экспериментов. |
Ни апоптоз, ни некроз не индуцируются амигдалином.
После введения амигдалина не было выявлено ни значительного раннего или позднего апоптоза, ни индукции некроза (данные не представлены).
Амигдалин изменяет процент клеток почечно-клеточного рака в фазах G0/1, S и G2/M
Амигдалин значительно увеличил процент клеток Caki-1 и A498 в фазе G0/G1 и уменьшил количество клеток в фазе S и G2/M через 24 ч и 2 недели ( рис. 3 ) воздействия по сравнению с необработанными контролями. В клетках KTC-26 амигдалин вызвал значительное снижение процента клеток в фазе G2/M, в то время как клетки в фазе S увеличились (24 ч, <2 недель). Не было измерено значительного увеличения процента клеток в фазе G0/G1 после 24-часовой обработки амигдалином в клетках KTC-26. Через 2 недели обработки амидалином в клетках KTC-26, сопровождавшейся увеличением S-фазы, количество клеток в фазе G0/G1 значительно снизилось ( рис. 3 ) по сравнению с контролем.
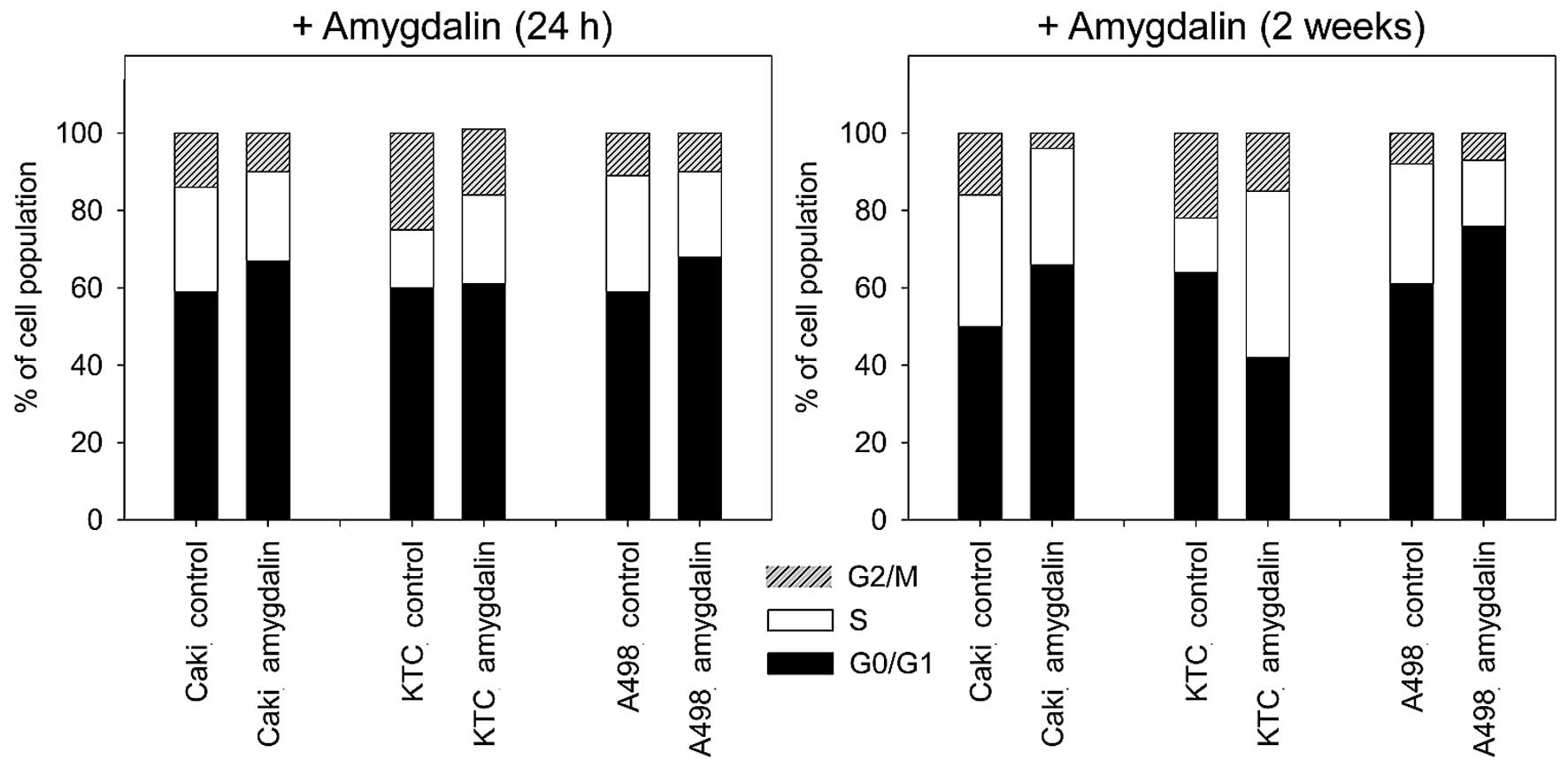 |
Рисунок 3Влияние амигдалина на распределение клеток почечно-клеточной карциномы (ПКР) в различных фазах клеточного цикла. Указан процент клеток Caki-1 (Caki), KTC-26 (KTC) и A498 в фазах G01/1, S и G2/M. Клетки ПКР, обработанные амигдалином в течение 24 ч или 2 недель, сравнивались с необработанными контрольными клетками. Показан один представитель из трех отдельных экспериментов. |
Амигдалин вызывает снижение экспрессии белка, активирующего клеточный цикл
Мы отметили, что изменения в прогрессии клеточного цикла сопровождались модуляцией белков, регулирующих клеточный цикл ( рис. 4 ). Во всех трех клеточных линиях, Caki-1, KTC-26 и A498, обработка амигдалином в течение 24 ч и 2 недель способствовала снижению регуляции активирующих клеточный цикл белков cdk1, cdk2 и cdk4, а также циклинов A и B, причем самые сильные эффекты были отмечены в отношении экспрессии cdk1 и циклина B. Циклин D1 также был снижен в Caki-1 и KTC-26 через 24 ч ( рис. 4 , левая панель) и в Caki-1 и A498 после 2 недель применения амигдалина ( рис. 4 , правая панель). Не было обнаружено выраженных изменений для циклина D3 ни в одной клеточной линии. В отличие от белков, активирующих клеточный цикл, экспрессия белка p19, ингибирующего клеточный цикл, была усилена после воздействия амигдалина в клеточных линиях Caki-1 (24 ч и 2 недели) и A498 (24 ч). p27 также был повышен в клетках A498 (24 ч) ( рис. 4 , левая панель). Однако p19 и p27 были снижены в клетках KTC-26, а снижение p27 было отмечено в клетках Caki-1 через 24 ч.
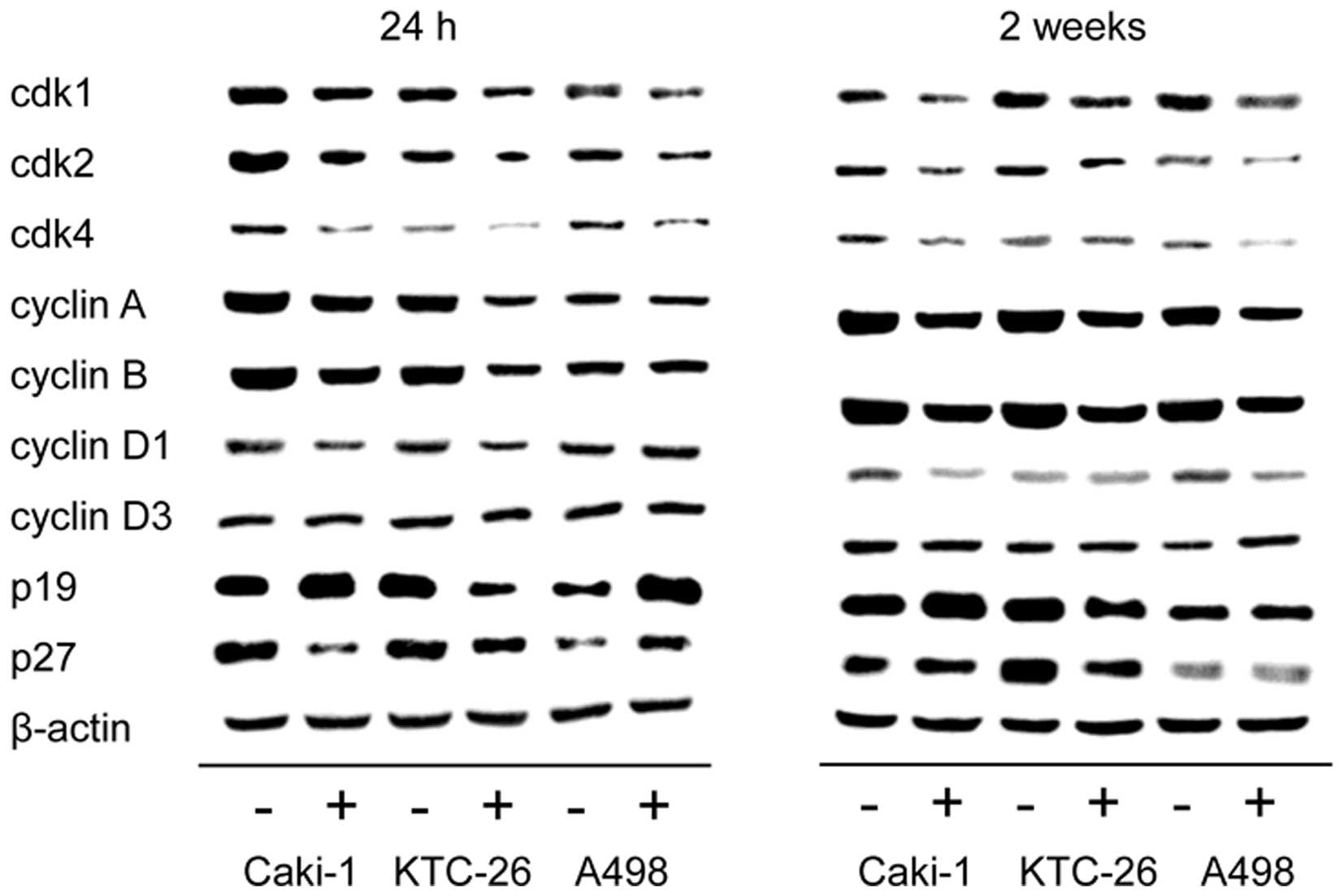 |
Рисунок 4Профиль экспрессии белков, регулирующих клеточный цикл, в клетках почечно-клеточной карциномы (RCC). Клетки Caki-1, KTC-26 и A498 после 24 ч (левая панель) или 2 недель (правая панель) воздействия амигдалина и необработанные контроли. −, контроль; +, амигдалин. β-актин служил внутренним контролем. Показан один представитель из трех отдельных экспериментов. |
Снижение уровня cdk1 и циклина B связано с ингибированием роста, вызванным амигдалином.
В связи с тем, что в настоящем исследовании наиболее яркое ингибирующее действие амигдалина было отмечено в отношении экспрессии cdk1 и циклина B, влияние этих двух белков на рост опухолевых клеток оценивалось путем блокирования их функции с помощью siRNA. Нокдаун cdk1 и циклина B привел к значительному ингибированию роста клеток во всех трех клеточных линиях по сравнению с необработанным и имитированным контролем ( рис. 5A–C ). Во всех трех клеточных линиях RCC блокирование экспрессии белков cdk1 и циклина B было подтверждено с помощью вестерн-блоттинга ( рис. 5D ).
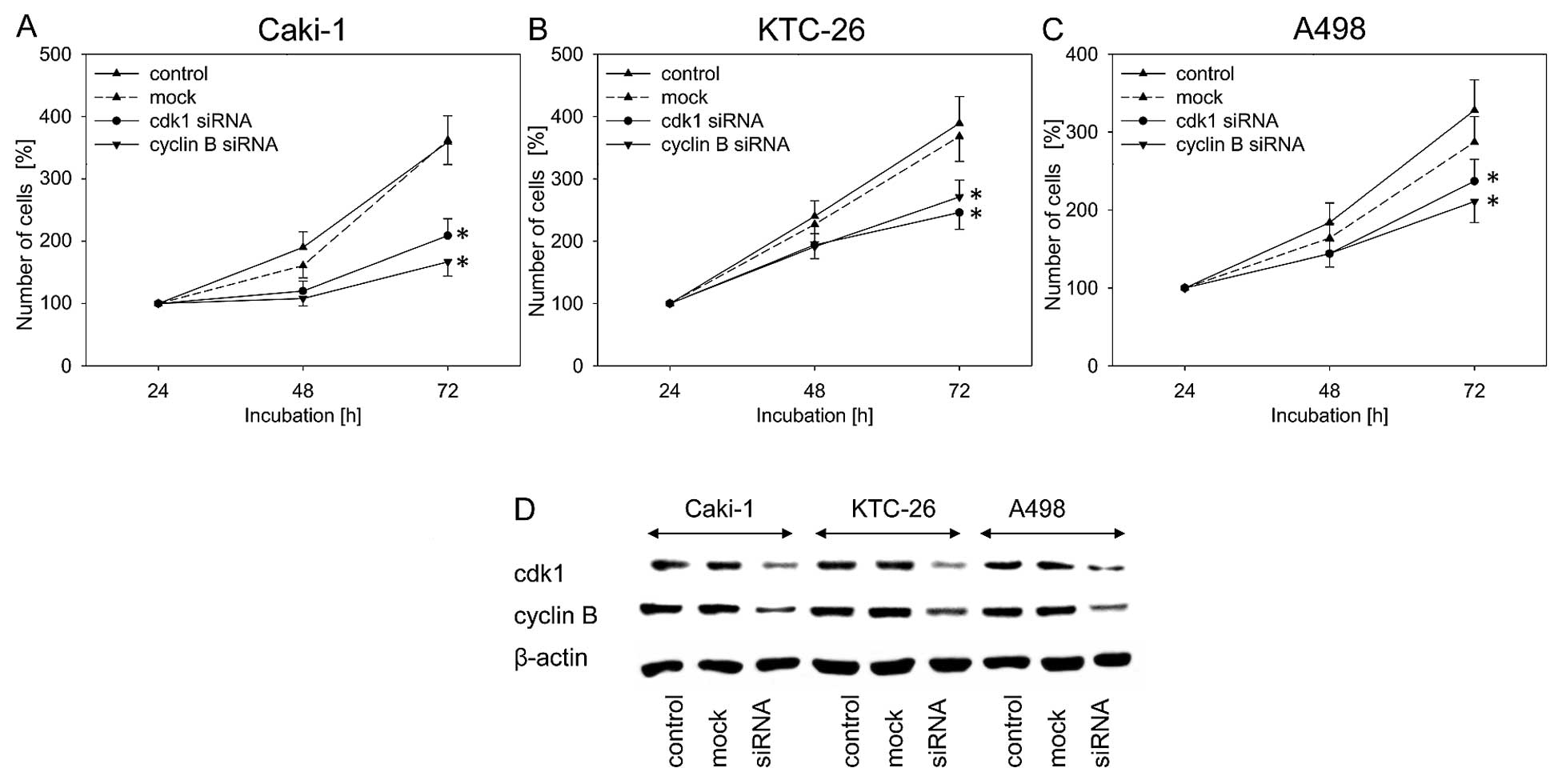 |
Рисунок 5Рост опухолевых клеток почечно-клеточного рака (RCC). (A) Caki-1, (B) KTC-26 и (C) A498 после функциональной блокировки с помощью siRNA, нацеленной на cdk1 и циклин B. AllStars отрицательный контроль siRNA служил в качестве контроля трансфекции (макет). Контроли оставались необработанными. Полоски указывают стандартное отклонение (SD). * p≤0,05, значимое различие с контролем. n=5 экспериментов. (D) Профиль экспрессии белка регулирующих клеточный цикл белков клеток Caki-1, KTC-26 и A498 после функциональной блокировки с помощью siRNA, нацеленной на cdk1 и циклин B. AllStars отрицательный контроль siRNA служил в качестве контроля трансфекции (макет). Контроли оставались необработанными. β-актин служил в качестве внутреннего контроля. Показан один представитель из трех отдельных экспериментов. |
Маркеры дифференциации модулируются обработкой амигдалином
Дедифференцировка опухолевых клеток сопровождается потерей E-кадгерина и повышенной экспрессией N-кадгерина. Экспрессия этих двух маркеров дифференцировки была определена для того, чтобы оценить, влияет ли амигдалин на дифференцировку опухолевых клеток. После 24 ч обработки амигдалином мы отметили значительное снижение поверхностного N-кадгерина в трех клеточных линиях ( рис. 6 ). После 2 недель обработки амигдалином было отмечено заметное увеличение экспрессии E-кадгерина на поверхности клеток Caki-1 и KTC-26 ( рис. 6A и B ). В клетках KTC-26 повышение E-кадгерина было связано со значительным снижением поверхностного N-кадгерина ( рис. 6B ). Однако экспрессия N-кадгерина в клетках Caki-1 значительно увеличилась после 2 недель воздействия амигдалина, хотя MFU все еще была ниже, чем для E-кадгерина ( рис. 6A ). Никакого существенного влияния на Е-кадгерин в клетках А498 после 2 недель применения амигдалина отмечено не было.
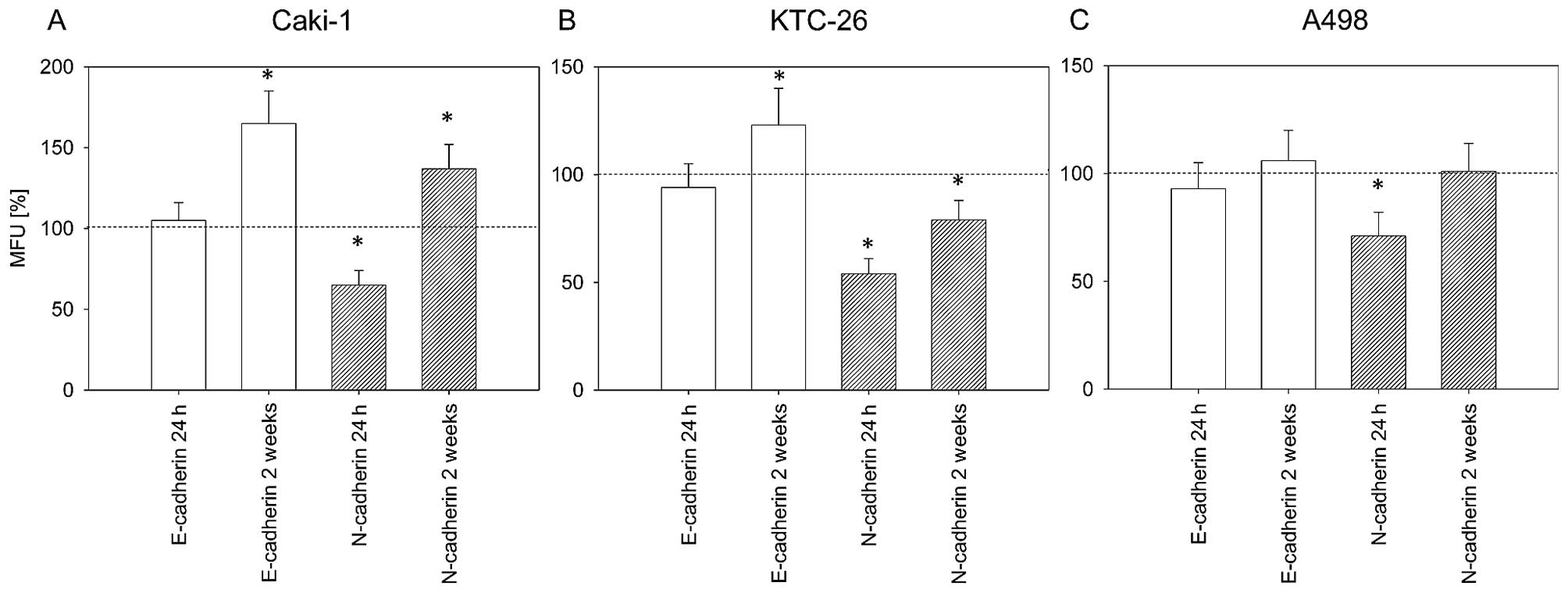 |
Рисунок 6Поверхностная экспрессия маркеров дифференциации E- и N-кадгерина на клетках почечно-клеточной карциномы (RCC). (A) Клетки Caki-1, (B) KTC-26 и (C) Клетки A498 через 24 часа и 2 недели применения амигдалина. Поверхностная экспрессия указана как средние относительные единицы флуоресценции [MFU (%)]. Контрольные значения были установлены на уровне 100% (пунктирная линия). Полоски указывают средние значения ± стандартное отклонение (SD). *p≤0,05 указывает на значимое отличие от контроля. n=5 экспериментов. |
Обсуждение
В настоящем исследовании мы отметили, что обработка линий клеток почечно-клеточного рака Caki-1, KTC-26 и A498 амигдалином вызвала значительное ингибирование роста и пролиферации клеток. Подобное снижение роста после применения амигдалина было отмечено в клетках немелкоклеточного рака легких ( 19 ) и рака мочевого пузыря ( 18 ) in vitro , а также в клетках рака шейки матки in vivo ( 20 ). На основании наших данных мы приходим к выводу, что ингибирование роста, вызванное амигдалином, не связано с апоптозом или некрозом. Другие раковые клетки, такие как клетки рака шейки матки, мочевого пузыря и простаты, реагируют на амигдалин апоптозом, что приводит к ингибированию роста ( 18 , 20 , 21 ). Таким образом, способ действия амигдалина, по-видимому, зависит от типа рака.
Хотя ингибирование роста во всех трех линиях клеток RCC сопровождалось изменениями в процентном содержании клеток в различных фазах клеточного цикла, изменения не были однородными. Обработка клеток Caki-1 и A498 амигдалином вызвала увеличение клеток в фазе G0/G1 за счет снижения S- (Caki-1 и A498) и G2/M-фаз (Caki-1). Обработка амигдалином вызвала увеличение клеток в фазе S в клетках KTC-26, в то время как фазы G2/M и G0/G1 были снижены через 2 недели. Повышение количества клеток в фазе S в KTC-26 после применения амигдалина, вероятно, свидетельствует об остановке клеточного цикла в S-фазе. В различных линиях клеток рака мочевого пузыря также была отмечена блокада роста, вызванная амигдалином, которая осуществлялась путем различного влияния на прогрессирование клеточного цикла, увеличивая процент клеток в фазе G0/G1 в одной линии клеток и повышая количество клеток в фазе S в другой ( 18 ).
Изменение процентного содержания фаз клеточного цикла коррелировало с модуляцией экспрессии белков, регулирующих клеточный цикл. Во всех трех линиях клеток RCC большинство белков, активирующих клеточный цикл, были снижены после лечения амигдалином, в частности cdk1 и циклин B. Известно, что Cdk1 является ключевой киназой для митотического входа ( 22 ). Было показано, что ось cdk1-циклин B в опухолевых клетках участвует в продвижении митоза и преодолении остановки клеточного цикла, зависящей от химиотерапии ( 23 ). Во всех трех линиях клеток RCC снижение cdk1 и циклина B было связано с ингибирующим эффектом, оказываемым амигдалином, что доказано с помощью нокдауна siRNA. Наряду с осью cdk1-циклин B, ось cdk2-циклин A также была отчетливо изменена в клетках RCC. Cdk2/циклин A способствует переходу из фазы G1 в фазу S и, как было показано, важен для ингибирования клеток рака мочевого пузыря, вызванного амигдалином ( 18 ). Мы предполагаем, что накопление клеток G0/G1 было обусловлено ингибирующим эффектом, который амигдалин оказывал на cdk2 и циклин B. Однако обработка клеточной линии KTC-26 амигдалином не привела к остановке фазы G0/G1, а скорее к остановке фазы S. Предположительно, это связано с ингибирующим клеточный цикл белком p19, уровень которого был повышен в клетках Caki-1 и A498 после применения амигдалина, но снижен в клетках KTC-26. p19 участвует в активности контрольной точки G1, останавливая вход клеток в фазу S ( 24 ). Ингибирование p19 увеличивает фракцию клеток в фазе S ( 25 ). Таким образом, это, вероятно, объясняет, почему мы отметили увеличение в фазе G0/G1 клеток Caki-1 и A498, в то время как клетки KTC-26 накапливались в фазе S. Следовательно, мы предполагаем, что вызванные амигдалином изменения в экспрессии регулирующего клеточный цикл белка ответственны за различные эффекты на прогрессирование клеточного цикла в разных клеточных линиях.
Во время возникновения и прогрессирования опухоли RCC происходит дедифференциация, сопровождаемая эпителиально-мезенхимальным переходом (EMT) ( 26 , 27 ). Во время перехода опухолевые клетки теряют эпителиальный (E)-кадгерин и приобретают нейральный (N)-кадгерин ( 26 , 28 ). Во всех трех линиях клеток RCC, использованных в этом исследовании, применение амигдалина в течение 24 часов вызвало значительное снижение экспрессии N-кадгерина, что указывает на повторную дифференциацию. Ранее N-кадгерин был связан с агрессивностью и злокачественным потенциалом RCC ( 29 ). Следовательно, мы предполагаем, что нарушение экспрессии N-кадгерина при 24-часовом применении амигдалина приводит к менее злокачественному типу опухоли. После 2 недель воздействия амигдалина стало очевидным переключение способа действия амигдалина, в основном затрагивающее экспрессию E-кадгерина. Экспрессия поверхности E-кадгерина Caki-1 и KTC-26 значительно увеличилась. В различных клетках RCC in vitro эпителиально-мезенхимальный переход, рост опухоли и агрессивный фенотип, как было показано, обратно связаны с низким уровнем E-кадгерина ( 30 , 31 ). Плохой прогноз и опухоли RCC высокой степени злокачественности были связаны с недостатком E-кадгерина ( 32 ). В опухолевой ткани RCC человека наблюдалось 3-кратное снижение E-кадгерина ( 33 ), и было постулировано, что экспрессия E-кадгерина в RCC является важным предиктором рецидива заболевания ( 34 ). Таким образом, мы предполагаем, что вызванное амигдалином увеличение E-кадгерина в клетках Caki-1 и KTC-26, которое мы отметили, указывает на повторную дифференцировку обратно к менее агрессивному фенотипу. Наблюдаемое переключение от снижения N-кадгерина к усилению E-кадгерина указывает на различные режимы действия амигдалина. Поскольку уровень N-кадгерина больше не снижался ни в одной из трех линий клеток после 2 недель воздействия амигдалина и даже повышался в клетках Caki-1, мы предполагаем, что соотношение между экспрессией E- и N-кадгерина имеет решающее значение для статуса дифференциации. Действительно, было показано, что эффект N-кадгерина зависит от экспрессии E-кадгерина ( 29 ).
В заключение, амигдалин ингибирует прогрессирование клеточного цикла и рост опухолевых клеток в клетках почечно-клеточного рака, по крайней мере частично, за счет нарушения экспрессии cdk1 и циклина B, тем самым оказывая противоопухолевое действие in vitro . Хотя in vitro не было обнаружено некротических эффектов , возможны токсические эффекты, вызванные деградацией амигдалина до HCN, и этот аспект требует оценки. Необходимы дальнейшие исследования с использованием животных для проверки эффектов амигдалина in vitro и оценки того, вызывает ли HCN цитотоксичность in vivo .
Благодарности
Это исследование было поддержано «Стифтунгом Бригитты и Норберта Мут» и «Проф. Доктор Фонд Карла и Герхарда Шиллеров